化合物H是一种香料,存在于金橘中,可用如下路线合成: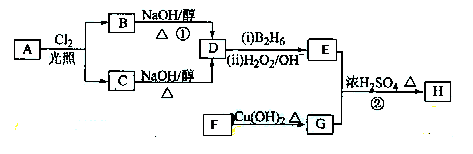
已知:
回答下列问题:
(1)11.2L(标准状况)的烃A在氧气中充分燃烧可以产生88 g CO2和45 g H2O。A的分子式是
(2)B和C均为一氯代烃,它们的名称(系统命名)分别为
(3)在催化剂存在下1 mol F与2 mol H2反应,生成3-苯基-1-丙醇。F的结构简式是_
(4)反应①的反应类型是 ;
(5)反应②的化学方程式为
(6)写出所有与G具有相同官能团的G的芳香类同分异构体的结构简式:
。
已知X、Y、Z、W四种元素是元素周期表中连续三个不同短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。试推断:
写出X、Y、Z、W四种元素的名称:
X、Y、Z、W
下表标出的是元素周期表的一部分元素,回答下列问题: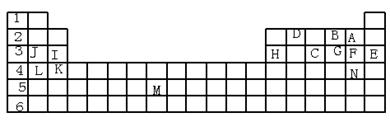
(1)表中用字母标出的14种元素中,化学性质最不活泼的是(用元素符号表示,下同),主族元素中金属性最强的是,非金属性最强是,常温下单质为液态的非金属元素是;属于过渡元素的是(该空用字母表示)。
(2)B、F、C气态氢化物的化学式分别为,
其中以最不稳定。
(3)第三周期中原子半径最小的是。
写出下列物质的电子式和结构式
(1)O2电子式:,结构式:
(2)H2S电子式:,结构式:
写出下列物质的电子式
(3)NaCl电子式:
(4)MgCl2电子式:
请填写下列空白
(1)原子由原子核和构成,原子核由和构成,
带(填质子中子或电子,下同)电(填正或负,下同),带电。
(2)在原子中,原子序数===。
(3)化学键可以分为键和键,键又可以分为极性和非极性。
(4)化学反应究竟要吸收能量还是要放出能量,主要取决于。化学反应的能量变化通常表现为热量的变化。若反应物总能量(填大于、小于或等于,下同)生成物总能量,为放热反应,若反应物总能量生成物总能量,为吸热反应。
(5)烷烃的概念:烃分子中碳原子之间都以碳碳结合成,剩余价键均与原子结合,使每个碳原子的化合价都达到“”,这样的烃又叫做“”。
下表为元素周期表的一部分,请回答有关问题:
| IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
|
| 一 |
(1) |
(2) |
||||||
| 二 |
(3) |
(4) |
(5) |
(6) |
(7) |
|||
| 三 |
(8) |
(9) |
(10) |
(1)请写出(1)--(10)号元素的元素符号
(2)表中能形成两性氢氧化物的元素符号是__________