含氮化合物对人类生活有十分重大的意义。
(1)目前广泛使用的工业合成氨方法是用氮气和氢气在一定条件下化合。
已知:N2(g)+O2(g) =2NO(g) △H=+180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905kJ/mol
2H2(g)+ O2(g)=2H2O(g) △H=-483.6kJ/mol
①写出工业合成氨的热化学方程式: 。
②实验室模拟合成氨,在2L密闭容器中投入1molN2和3mol H2,容器中氨气的体积分数随时间变化如图所示。则0~10min,NH3的平均速率为 ;达平衡时,N2的转化率为 。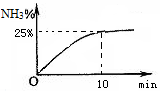
③若在②达平衡后,保持容器体积及温度不变,移走0.5molNH3,再达平衡时,N2的体积分数将 ,平衡常数 (填“增大”“减小”或“不变”)
(2)科学家一直致力于研究常温常压下“人工固氮”的方法。据报道:在常温常压条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水反应,生成NH3和一种单质。进一步研究NH3生成量与温度关系,部分实验数据如下(反应时间3h,其余条件一样)
| T/℃ |
30 |
40 |
50 |
| NH3生成量/10-6mol |
4.8 |
5.9 |
6.0 |
①写出常温下“人工固氮”反应的化学方程式: _此反应△H 0(填“>”、“<”或“=)。
②该反应中的催化剂TiO2的制取方法之一是将TiCl4气体导入氢氧火焰中(700~1000℃)进行水解。写出TiCl4水解的化学方程式: 。
③在上述固氮过程中,除加入催化剂外,能提高生产速率,但不降低产率的措施还可以是 。
A.适当升高温度 B.将氨气液化分离
C.增大反应物N2的浓度 D.增大压强
分析下列有机化合物的结构简式,完成填空。
①CH3CH2CH2CH2CH3 ②C2H5OH ③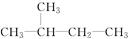
④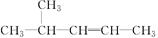 ⑤
⑤ ⑥
⑥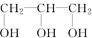 ⑦
⑦
⑧ ⑨
⑨ ⑩
⑩ ⑪
⑪
⑫CH3CHBrCH3 ⑬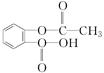 ⑭
⑭ ⑮
⑮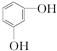
请你对以上有机化合物进行分类,其中:
(1)属于烷烃的是__①③__________;(2)属于烯烃的是____④_________ ;(3)属于芳香烃的是_____⑤⑧⑨_____;(4)属于卤代烃的是______⑫________;(5)属于醇的是____②⑥________;(6)属于醛的是________⑦⑪_______ ;(7) 属于羧酸的是___⑩⑬
_________;(8)属于酯的是____⑬⑭________;(9) 属于酚的是___⑮__________ 。
写出下列有机物的结构简式或名称:
⑴ 间甲基苯乙烯,⑵苯甲酸乙酯,
⑶ ,⑷
,⑷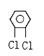 。
。
(5)命名下图所示有机物:__________________;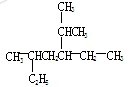
(6)若(5)中有机物是某单炔烃经过加成反应得到的,请写出此炔烃可能的结构简式__________________;
(11分) 已知有机物A不能发生银镜反应,也不能使溴水褪色;在一定条件下,A的苯环上发生卤代反应时只能产生两种一卤代物;A在一定条件下还能发生如下图所示的反应。B与过量的银氨溶液能发生银镜反应;C中具有八元环结构;D溶液中加入浓硝酸会变黄色;E能使溴水褪色。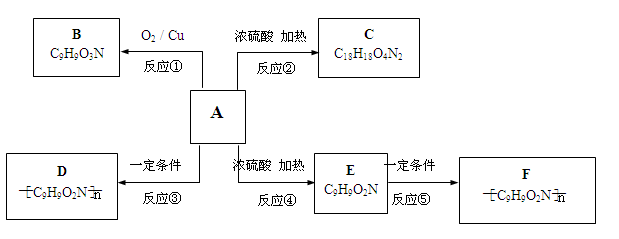
请回答:
(1)写出A的化学式:_______________;
AD的反应类型:;EF的反应类型:;
(2)写出下列变化的化学方程式: AC:;
EF:;
(3)写出D的结构简式: ____________ ;
(4)B发生银镜反应的离子方程式______________________;
(5)若E中的苯环和各官能团均保持不变,苯环上取代基的数目、位
置也不改变。写出符合上述条件的E的同分异构体有种。
某有机物A的分子式为C6H10Br2,不能使溴水褪色,G的分子式为C4H8,能使溴水褪色,A、G的核磁共振氢谱如下。G为石油化工基本原料,K为高分子化合物,1mol J与足量金属钠反应生成22.4L(标准状况)氢气,C、D互为同分异构体。各有机物之间的转化关系如下:
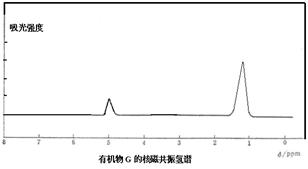
已知: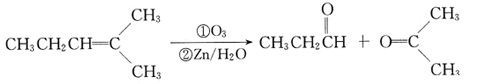
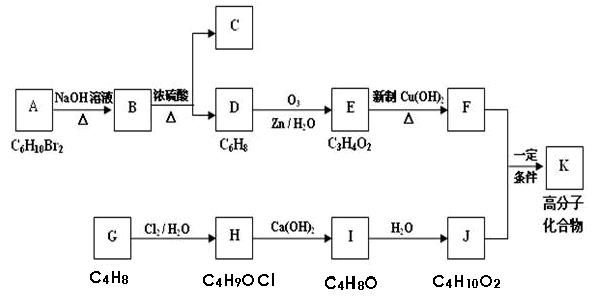
回答下列问题:
(1)C的结构简式为,
(2)写出B→D的化学方程式。
(3)A在一定条件下也能直接反应生成D,写出相应的化学方程式(需注明反应条件)
(4)写出F和J反应生成K的化学方程式
(5)有机物R与B互为同分异构体,满足下列条件的R共有种,写出任意的两种
①与NaOH溶液反应②不能与NaHCO3溶液反应③碳链无支链
用l-丁醇、溴化钠和过量较浓H2SO4混合物为原料,在实验室制备1-溴丁烷,并检验反应的部分副产物。现设计如下装置,其中夹持仪器、加热仪器及冷却水管没有画出。请根据实验步骤,回答下列问题:
⑴关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷。竖直冷凝管的作用是,写出该反应的化学方程式。
⑵理论上,上述反应的生成物还可能有:丁醚、1-丁烯、溴化氢、硫酸氢钠、水等。熄灭A处酒精灯,在竖直冷凝管上方塞上塞子、打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物。B、C中应盛放的试剂分别是、。
(3)相关有机物的数据如下:
为了进一步精制1-溴丁烷,继续进行了如下实验:待烧瓶冷却后,拔去竖直的冷凝管,塞上带温度计的橡皮塞,关闭a,打开b,接通冷凝管的冷凝水,使冷水从(填c或d)处流入,迅速升高温度至℃,收集所得馏分。
(4)若实验中所取1-丁醇、NaBr分别为7.4 g、13.0 g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6 g 1-溴丁烷,则1-溴丁烷的产率是。