已知:A、B、C、D四种短周期元素,其化合价最高正价数依次为1、4、5、7,已知B原子的核外次外层电子数为2。A、C原子的核外次外层电子数为8。D元素的最高价氧化物对应的水化物是已知含氧酸中酸性最强的酸。试回答下列有关的问题:
(1)写出C元素原子的价电子轨道表达式 ;D元素的价电子排布式 。
(2)已知B元素与氢元素形成的气态化合物在标准状况下的密度为1.161g·L-1,则在该化合物的分子中B原子的杂化方式为 。
(3)已知C、D两种元素形成的化合物通常有CD3、CD5两种。这两种化合物中一种为非极性分子,一种为极性分子,则属于极性分子的化合物的化学式是 。
(4)由B元素形成具有正四面体结构的晶体和由C元素形成具有正四面体结构的晶体相比,熔点较高的晶体是 (填写晶体的名称)。
(5)由A、D两元素形成的化合物组成的晶体中,阴、阳离子都具有或近似具有球型对称结构,它们都可以看作刚性圆球,并彼此“相切”。如下图所示为A、D形成化合物的晶胞结构图以及晶胞的剖面图: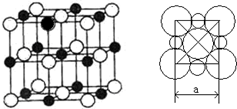 若
若
a=5.6×10-8cm,则该晶体的密度为 g·cm-3(精确到小数点后1位)。
有一包白色固体,可能含有CaCO3、Na2SO4、KNO3、CuSO4、BaCl2五种物质中的一种或几种。现进行如下实验:
(1)取少量固体粉末加到足量水中,得到白色沉淀,上层为无色清液。
(2)继续往其中加入足量稀硝酸,白色沉淀完全消失,并有气泡产生。
(3)取少量⑵中的溶液滴加Ba(NO3)2溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶。
根据上述实验现象判断:该白色固体中一定含有__________________,一定不含有________,可能含有_____________。
如何验证可能存在的物质
如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2 mol SO2和1 mol O2,乙中充入2 mol SO3和1 mol He,此时K停在0处。在一定条件下发生可逆反应:2SO2(g)+O2(g) 2SO3(g),反应达到平衡后,再恢复至原温度,回答下列问题:
2SO3(g),反应达到平衡后,再恢复至原温度,回答下列问题:
(1)若固定隔板K,能表示甲容器中一定达到化学平衡的是
| A.甲中气体的总压强不变 | B.各气体的物质的量浓度不变 |
| C.混合气体的平均摩尔质量不变 | D.混合气体的密度不变 |
E.反应速率v(SO2)=v(SO3)
(2)达到平衡后隔板K是否可能处于0刻度 ________(填“可能”或“不可能”)。若K最终停留在0刻度左侧a处,则a一定小于________。
(3)若平衡时,K最终停留在左侧刻度1处,则甲中SO3的物质的量为________mol,乙中SO3的转化率________50%(填“>”、“<”或“=”),活塞F最终停留在右侧刻度______处(填下列序号:①<6 ②>6 ③=6)。
(4)若一开始就将K、F固定,其他条件均不变,甲平衡后压强变为开始压强的0.8倍,则甲、乙都达到平衡后,两容器的压强之比为P甲:P乙=
常温下, 浓度均为0. 1 mol/L的6种溶液的pH如下表:
| 序号 |
a |
b |
c |
d |
e |
f |
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
NaAlO2 |
| pH |
8. 8 |
9. 7 |
11. 6 |
10. 3 |
11. 1 |
11. 3 |
(1)上述溶液中的阴离子结合H+能力最弱的为 。(填阴离子化学式)
(2)NaAlO2溶液呈碱性的原因是(用离子方程式表示)。将溶液加热蒸干最后得到的固体产物是;
(3)结合表中数据分析, 与0. 1 mol/L的CH3COONa溶液中水的电离程度相同的有 (填字母代号)。
A.pH="8." 8的NaOH溶液 B. pH="5." 2的NH4Cl溶液 C.pH="5." 2的盐酸
D. 0. 1 mol/L的NaCN溶液E.pH="8." 8的Na2CO3溶液
(4)将浓度均为0. 1 mol/L的b、c等体积混合, 所得溶液中各离子浓度关系正确的有。
A.c(Na+)= c(CO32-) +c(HCO3-) +c(H2CO3)
B. 2c(Na+)=3c(CO32-) +3c(HCO3-) +3c(H2CO3)
C. c(OH-)= c(H+) +c(HCO3-) +2c(H2CO3)
D. c(Na+) +c(H+) = 2c(CO32-) +c(HCO3-) +c(OH-)
E. c(Na+)>c(HCO3-)> c(CO32-) > c(OH-)> c(H+)
F. c(Na+)> c(CO32-) > c(HCO3-) > c(H+)> c(OH-)
(5)0.2 mol/LHCl与0.1 mol/L NaAlO2溶液等体积混合溶液后离子浓度顺序为。
(1) 8g液态的CH3OH在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出Q kJ的热量。试写出液态CH3OH燃烧热的热化学方程式 。
(2)在化学反应过程中,破坏旧化学键需要吸收能量,形成新化学键又会释放能量。
| 化学键 |
H—H |
N—H |
N≡N |
| 键能/kJ·mol-1 |
436 |
391 |
945 |
已知反应N2+3H2=2NH3 ΔH=a KJ/mol。
试根据表中所列键能数据计算a的数值为: 。
(3)已知:C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ/mol
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599 kJ/mol
根据盖斯定律,由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的热化学方程式:
。
食盐是日常生活的必需品,也是重要的化工原料。
粗食盐常含有少量Ca2+、Mg2+、Fe3+、SO42—等杂质离子,实验室提供的试剂如下:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳。实验室提纯NaCl的流程如下:
(1)欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42—离子,选出A所代表的多种试剂,按滴加顺序依次为i NaOH ii iii(填化学式)。
(2)请写出下列试剂加入时发生反应的离子反应方程式:
加入试剂i:;
加入试剂iii:。
(3)洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为。(从提供的试剂中选)
(4)实验中用到的盐酸的物质的量浓度为0.400mol/L,现实验室某浓盐酸试剂瓶上的有关数据如下:
欲用上述浓盐酸配制实验所需浓度的稀盐酸480mL,
①配制需要的玻璃仪器有(填仪器名称)
②需量取的浓盐酸的体积为:。