NaCl在生活、生产和科研中都有广泛的用途。
I. 从海水中提取的粗盐含有Ca2+、Mg2+、SO4-等离子,为制备精盐可使用以下四种试剂:①Na2CO3溶液 ②BaCl2溶液 ③NaOH溶液 ④盐酸(用于沉淀的试剂均稍过量)。
(1)加入试剂的合理顺序是________(填选项)。
a. ①②③④ b. ③①②④ c. ②①③④ d. ③②①④
(2)加入过量Na2CO3溶液的作用是________________。
II. 实验室要配制100 mL 0.2 mol·L-1 NaCl溶液。
(1)用托盘天平称氯化钠固体的质量是________g。
(2)配制溶液需要使用的主要玻璃仪器有烧杯、玻璃棒、胶头滴管和________。
(3)下列操作中,可能造成所配制溶液的浓度偏低的是________(填选项)。
a. 没有洗涤烧杯和玻璃棒 b. 定容时,俯视刻度线
c. 洗涤后的容量瓶中残留少量蒸馏水
下图为某实验小组的同学制备乙烯及验证乙烯性质的部分装置图,请回答:
(1)烧瓶中加入的两种试剂是__________________________;
(2)温度计的作用是____________________,碎瓷片的作用是_________________________;
(3)写出实验中产生乙烯的化学方程式:_____ __;
(4)甲同学认为:溴水褪色的现象不能证明乙烯具有不饱和性,其原因是烧瓶中液体呈棕黑色而产生_____________气体。乙同学经过仔细观察后认为:试管中另一个现象可证明乙烯具有不饱和性,这个现象是 ________________。丙同学为验证这一反应是加成而不是取代,提出了将杂质气体吸收后,可用pH试纸来测试反应后溶液的酸性,理由是____________________________________;
(5)处理上述实验中烧瓶内废液的正确操作是_______________。
| A.废液直接倒入下水道 |
| B.废液倒入空废液缸中 |
| C.将水倒入烧瓶中 |
| D.废液倒入盛有水的塑料桶中,经处理后再倒入下水道 |
应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。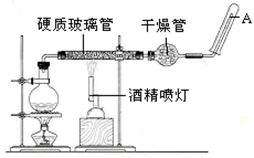
(1)写出该反应的化学方程式,其中氧化剂是, 8.4g铁粉参加反应,转移电子mol。
(2)干燥管内使用的干燥剂可以是下列物质中的(填序号)。
①浓硫酸②碳酸钠③碱石灰④过氧化钠
(3)硬质玻璃管中石棉绒的作用是,圆底烧瓶中盛装水和,加入后者的作用是。
(4)实验开始时应先点燃,实验结束时应先熄灭,检验生成的气体的方法是。
I.(4分)某温度下的溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L。x与y的关系如图所示:
(1)该温度下,中性溶液的pH=。
(2)该温度下0.01 mol/L NaOH溶液的pH=。
II. (6分)某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
| 温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡总压强(kPa) |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
| 平衡气体总浓度 (×10-3mol/L) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①可以判断该分解反应已经达到化学平衡的是(填字母)。
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,计算25.0℃时的分解平衡常数为。
(2)已知:NH2COONH4+2H2O NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
③计算25℃时,0~6min氨基甲酸铵水解反应的平均速率为。
④根据图中信息,如何说明水解反应的平均速率随温度升高而增大:
。
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一配制一定物质的量浓度的醋酸溶液
取冰醋酸配制250mL 0.2000mol/L的醋酸溶液,需要用到的玻璃仪器有量筒、烧杯、玻璃棒、和。
实验二探究浓度对醋酸电离程度的影响
将0.2000mol/L的醋酸溶液稀释成所需浓度的溶液,再用pH计测定25℃时不同浓度的醋酸的pH,结果如下:
| 醋酸浓度(mol/L) |
0.0010 |
0.0100 |
0.0200 |
0.1000 |
0.2000 |
| pH |
3.88 |
3.38 |
3.23 |
2.88 |
2.73 |
回答下列问题:
(1)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是
。
(2)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度
。(填“增大”“减小”或“不变”)
实验室常用的几种气体发生装置如图A、B、C所示: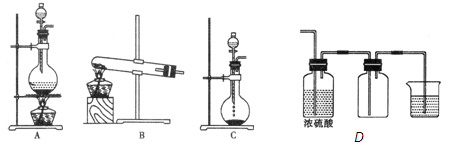
(1)实验室可以用B或C装置制取氨气,如果用C装置,通常使用的药品是。检查C装置气密性是否良好的操作方法是。
(2)气体的性质是气体收集方法选择的主要依据。下列性质与收集方法无关的是(填序号,下同。)
①密度②颜色③溶解性④热稳定性⑤与氧气反应
下图是某学生设计收集气体的几种装置,其中不可行的是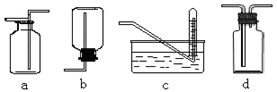
(3)若用A装置与D装置相连制取收集X气体,则X可能是下列气体中的_______
①CO2② NO③ Cl2④H2
其中在D装置中连接小烧杯的目的是________________________。