如图所示装置:
(1)若烧杯中溶液为稀硫酸,则观察到的现象为 。
两极反应式为:正极 ;
负极 ,该装置将 能转化为 能。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为 ,
总反应方程式为 。
现有九种物质:①铁单质②石墨③氯气④硫酸钡晶体⑤纯硫酸⑥盐酸⑦石灰水⑧乙醇⑨熔化的硝酸钾。
(1)其中能导电的是________________,属于电解质的是______________,既不是电解质也不是非电解质的是_________________。
(2)请写出下列反应的离子方程式:
①与③反应:_________________________。
①与⑥反应:_________________________。
③与⑦反应:_________________________。
(3)2005年3月29日,京沪高速公路发生特大氯气泄露事故,多人伤亡,附近绿地全部枯黄。翻落的氯槽罐被移至水池,用某种物质进行处理,消除了危险源,这种物质最好是 。附近居民为防止吸入氯气而引起中毒,可以用浸透某种物质的毛巾捂住口鼻,这种物质可能是 。
| A.Na2CO3 | B.NaOH |
| C.Na2O2 | D.HClO |
在25℃,101kPa下将15LO2通入10LCO和H2的混合气体中,使其完全燃烧,干燥后恢复至原来的温度和压强。
(1)若剩余气体的体积是15L,则原混合气体中V(CO)= L,V(H2)= L。
(2)若剩余气体的体积是a L,则原混合气体中V(CO):V(H2)= 。
(3)若剩余气体的体积是a L,则a的取值范围是 。
标准状况下,一密闭容器被无摩擦、可滑动的两隔板a和b分成甲、乙两室,如图所示。在乙室中充入0.6mol HCl,甲室中充入NH3、H2的混合气体,静止时活塞位置如下图。已知甲、乙两室中气体的质量之差为10.9g。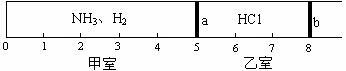
请回答下列问题:
(1)甲室中气体的物质的量为___________mol。
(2)甲室中气体的质量为__________g。
(3)甲室中NH3、H2的物质的量之比为_____________,质量比为___________。
(4)经过查资料知道HCl+NH3=NH4Cl(NH4Cl常温下是固体),如果将板a去掉,当HCl与NH3完全反应后,活塞b将静置于刻度“___________”处(填数字)。
O2和O3是氧元素的两种单质,根据其分子式完成下列各题:
(1)等质量的O2和O3所含分子个数比为 ,原子个数比为 。
(2)等温等压下,等体积的O2和O3所含原子个数比为 ,质量之比为 。
(3) g NaOH溶解在90g水中,才能使每十个水分子中溶有一个钠离子。
(4)常温常压下,14 g由N2和CO组成的混合气体中含有的原子数目为 。
[化学——有机化学基础](10分)
某吸水材料与聚酯纤维都是重要化工原料,它们的合成路线如下: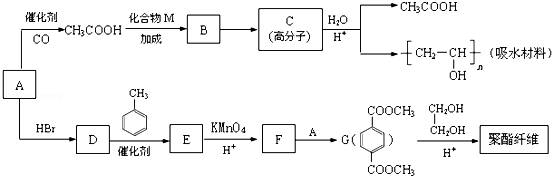
已知:①有机物A能与Na反应,相对分子质量为32。
②
③RCOOR′+R″OH RCOOR″+R′OH(R、R、R,代表烃基)
RCOOR″+R′OH(R、R、R,代表烃基)
(1)A的结构简式是____________,B中含氧官能团的名称是_____________。
(2)C的结构式是_______________,D→E的反应类型是_________________。
(3)F+A→G的化学方程式是_________________________。
(4)CH3COOH+CH≡CH→B的化学方程式是______________。
(5)G的同分异构体有多种,满足下列条件的共有___________种。
①苯环上只有两个取代基
②1mol与足量的NaHCO3溶液反应生成2mol CO2气体
(6)G→聚酯纤维的化学方程式是_______________________________。