现有3.58gNa2CO3和NaHCO3的固体混合物,将其制成溶液后,边搅拌边逐滴滴加80.0ml 1.0mol/L 盐酸,反应完全后生成的CO2气体折算成标准状况下的体积为896ml(设气体全部逸出,下同)。回答下列问题:
(1)其中 过量。
(2)固体混合物中Na2CO3和NaHCO3的物质的量之比为 。
(3)取xg上述Na2CO3和NaHCO3的固体混合物,将其制成溶液后,边搅拌边逐滴滴加40.0ml 1.0mol/L 盐酸,反应完全后生成的CO2气体折算成标准状况下的体积为448ml,则x的值可能为 。
(4)取xg上述Na2CO3和NaHCO3的固体混合物,将其制成溶液后,边搅拌边逐滴滴加40.0ml 1.0mol/L 盐酸,反应完全后生成的CO2气体折算成标准状况下的体积为yml,当2.864≤x<14.32时,y与x的函数关系式是y= 。
明矾石经处理后得到明矾[KAl(SO4)2·12H2O]。从明矾制备Al、K2SO4、和H2SO4的工艺过程如下所示:
焙烧明矾的化学方程式为:
请回答下列问题:
(1)在焙烧明矾的反应中,氧化剂是,氧化剂与还原剂的物质的量之比为
(2)从水浸后的滤液中得到K2S04晶体的方法是____。产物K2SO4中K元素的鉴定操作方法是____。
(3)向明矾溶液中逐滴加入Ba(OH)2溶液至SO2—4恰好沉淀完全的离子反应方程式为。
(4)焙烧产生的SO2可用于制硫酸。已知25℃、l0lkPa时: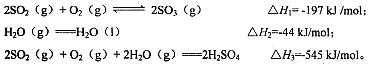
则SO3(g)与H2O(1)反应的热化学方程式是。
(5)假设整个过程中没有物质损失,理论上三种最终产物K2SO4,Al和H2SO4的物质的量之比为____
化合物A、B是中学常见的物质,其阴阳离子可从下表中选择
(1)若A、B的水溶液均为无色,B的水溶液呈碱性,且混合后只产生不溶于稀硝酸的白色沉淀及能使红色石蕊试纸变蓝的气体。
①A的化学式为____;B的化学式为____;
②A、B溶液混合后加热量中性反应的离子方程式为。
(2)若A的水溶液呈浅绿色,B的水溶液呈无色且其焰色反应为黄色。向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合亦无明显变化。则
①A为____;B为;
②经分析上述过程中溶液变黄的原因可能是有两种:
I;相关的离子反应方程式。
II;相关的离子反应方程式。
A、B、C、D、F属于元素周期表中的短周期元素,并且其中只有一种金属元素。A是元素周期表所有元素中原子半径最小的;B和C原子都只有两个电子层,B原子的一个电子层了电子数是另一层的两倍;C的原子的两层电子数之和是两层电子数之差的两倍;D原子的一个电子层的电子数是另两层电子数之和;E的+1价阳离子与C的阴离子有相同的电子层结构。请按要求同答下列问题:
(1)D元素在元素周期表中的位置是,写出由A和C组成的原子个数比为1:1的化合物的电子式。
(2)由上述元素组成的化合物中属于直线型分子是(只要求写出两种,用化学式表示)。
(3)上述元素形成的化合物中通常能污染空气的是(至少写出两种),其中有两种污染物有同种元素并能相互反应,该反应的化学方程式为。反应中氧化产物与还原产物的物质的量之比是。
(4)写出由B、C、E三种元素组成两种氧化物互相反应有气体生成的化学方程式;
(5)由A、B、C、E四种元素形成的化合物的水溶液与过量石灰水反应的离子方程式是:。
常温下,一种烷烃A和一种烯烃B组成混合气体,A或B分子最多只含有4个碳原子,且A分子的碳原子数比B分子多。
(1)将1L该混合气体充分燃烧,在同温同压下得到2.5LCO2气体。试推断原混合气体中A和B所有可能的组合及其体积比,并将结果填入下表(不一定填满):
| 组合 |
A的分子式 |
B的分子式 |
A和B的体积比(Va:Vb) |
| ① |
|
|
|
| ② |
|
|
|
| ③ |
|
|
|
| ④ |
|
|
|
(2)120℃时,取1L该混合气体与9L氧气混合,充分燃烧后,当恢复到120℃和燃烧前的压强时,体积增大5%,试通过计算确定A和B的分子式。
(每空2分,共8分)二元酸H2A在水中的电离情况是:H2A=H++HA-和HA- H++A2-,写出下列物质的水溶液的相应关系式:
H++A2-,写出下列物质的水溶液的相应关系式:
(1)NaHA溶液中的离子浓度大小关系:
(2)NaHA溶液的物料守恒式:
(3)NaHA溶液的电荷守恒式:
(4)NaHA溶液的质子守恒式: