M 2+ 离子有2个电子层,则M在周期表的位置是
| A.第二周期零族 | B.第二周期Ⅷ族 |
| C.第二周期ⅡA族 | D.第三周期ⅡA族 |
在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:
aA(g) + bB(g)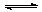 xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表
xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表
示温度,p表示压强)。在图中,Y轴是指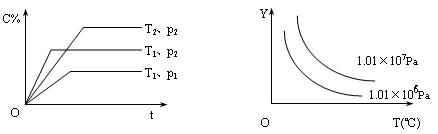
A.反应物A的百分含量B.平衡混合气中物质B的百分含量
C.平衡混合气的密度D.平衡混合气的平均摩尔质量
某探究小组利用丙酮的溴代反应(CH3COCH3+Br2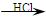 CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
| 实验 序号 |
初始浓度c/mol·L-1 |
溴颜色消失 所需时间t/s |
||
| CH3COCH3 |
HCl |
Br2 |
||
| ① |
0.80 |
0.20 |
0.0010 |
290 |
| ② |
1.60 |
0.20 |
0.0010 |
145 |
| ③ |
0.80 |
0.40 |
0.0010 |
145 |
| ④ |
0.80 |
0.20 |
0.0020 |
580 |
分析实验数据所得出的结论不正确的是
| A.增大c(Br2),v(Br2)增大 | B.实验②和③的v(Br2)相等 |
| C.增大c(HCl), v(Br2)增大 | D.增大c(CH3COCH3), v(Br2)增大 |
CuI是一种白色难溶于水的固体,以石墨为阴极,铜为阳极组成电解池,含有酚酞和淀粉KI的溶液作电解液,电解开始一段时间,阴极区溶液变红,阳极区仍为无色,电解相当长时间后,阳极区才呈深蓝色,则电解开始阶段的电极反应是
| A.阳极:Cu-2e-=Cu2+阴极:Cu2++2e-=Cu |
| B.阳极:2Cu+2I――2e-=2CuI阴极:2H++2e-=H2↑ |
| C.阳极:2I――2e-=I2 阴极:2H++2e-=H2↑ |
| D.阳极:4OH--4e-=2H2O+O2↑阴极:4H++4e-=2H2↑ |
下图是一种航天器能量储存系统原理示意图。下列说法正确的是
| A.该系统中只存在3种形式的能量转化 |
B.装置Y中负极的电极反应式为: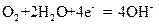 |
| C.装置X能实现燃料电池的燃料和氧化剂再生 |
| D.装置X、Y形成的子系统能实现物质的零排放,并能实现 |
化学能与电能间的完全转化
下面有关电化学的图示,完全正确的是