工业上用丁烷氧化法制醋酸,反应的化学方程式可表示为:
2C4H10+5O2 4CH3COOH+2H2O
4CH3COOH+2H2O
现用58吨丁烷为原料制取醋酸,求:
(1)理论上需要标准状况下的空气 m3(设空气中O2、N2的体积分数分别为0.2、0.8),同时生成水 吨。
(2)若生成的醋酸溶解在生成的水中,所得醋酸的质量分数为 %。
(3)若同时生产质量分数为100%的冰醋酸m1吨和质量分数为50%的醋酸m2吨,且 ,需补充水y吨,则y与x的关系式为 (用含x的代数式表示y);若不补充水,则m1+m2= 。
,需补充水y吨,则y与x的关系式为 (用含x的代数式表示y);若不补充水,则m1+m2= 。
将过量Mg粉溶于100mL 1.5mol·L-1稀H2SO4中,反应结束后,滤去多余Mg粉,滤液在t℃下蒸发,当滤液质量为72.0g时开始析出MgSO4·xH2O晶体,当析出晶体12.3g时,剩下滤液48 .0g。通过计算请回答下列问题(请写出计算过程)。
.0g。通过计算请回答下列问题(请写出计算过程)。
(1)生成标准状况下 的气体体积;
的气体体积;
( 2)开始析出MgSO4·xH2O晶体时溶液的质量分数;
2)开始析出MgSO4·xH2O晶体时溶液的质量分数;
(3)MgSO4·xH2O中的x值。
红磷 P (s)和 Cl2(g)发生反应生成 PCl3(g)和 PCl5(g)。如图所示(图中的△H表示生成 l mol 产物的数据)。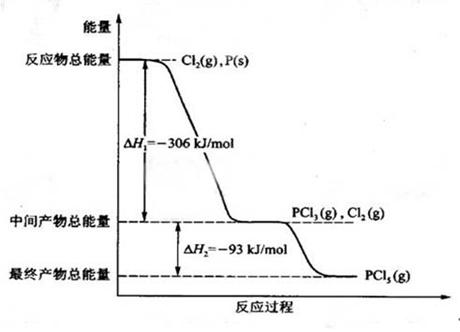
根据上图回答下列问题:
(1)P和CI2反应生成 PC13的热化学方程式是______________________________;
(2)PC15分解成 PC13和 Cl2的热化学方程式是_____________________________;上述分解反应是一个可逆反应。温度 Tl时,在密闭容器中加人 0.80 mol PC15,反应达平衡时 PC15还剩 0.60 mol ,其分解率 al等于_________________;若反应温度由 Tl升高到T2,平衡时 PC15的分解率为a2,a2_________ al(填“大于”、“小于”或“等于”) ;
(3)工业上制备 PC15通常分两步进行,先将 P 和 C12反应生成中间产物 PC13,然后降温,再和Cl2反应生成 PCl5。原因是___________________________________
______________________________________________________;
(4)P 和 C12分两步反应生成 1 mol PC15的△H3==__________________,一步反应生成 1 molPC15的△H4____________△H3(填“大于”、“小于”或“等于”)。
(5)PC15与足量水充分反应,最终生成两种酸,其化学方程式是
______________________________________________________________________。
将过量Mg粉溶于100mL 1.5mol·L-1稀H2SO4中,反应结束后,滤去多余Mg粉,滤液在t℃下蒸发,当滤液质量为72.0g时开始析出MgSO4·xH2O晶体,当析出晶体12.3g时,剩下滤液48 .0g。通过计算请回答下列问题(请写出计算过程)。
.0g。通过计算请回答下列问题(请写出计算过程)。
(1)生成标准状况下 的气体体积;
的气体体积;
( 2)开始析出MgSO4·xH2O晶体时溶液的质量分数;
2)开始析出MgSO4·xH2O晶体时溶液的质量分数;
(3)MgSO4·xH2O中的x值。
2 g Cu2S和CuS的混合物在酸性溶液中用400 mL 0.075 mol·L-1 KMnO4溶液处理,发生反应如下: +5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O +5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
______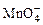 +______Fe2++______H+=______Mn2++______Fe3++______H2O
+______Fe2++______H+=______Mn2++______Fe3++______H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为________mol。
(3)欲配制500 mL 0.1 mol·L-1 Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M="392" g·mol-1)的质量为________g。
(4)混合物中Cu2S的质量分数为_______。
红磷 P (s)和 Cl2(g)发生反应生成 PCl3(g)和 PCl5(g)。如图所示(图中的△H表示生成 l mol 产物的数据)。
根据上图回答下列问题:
(1)P和CI2反应生成 PC13的热化学方程式是______________________________;
(2)PC15分解成 PC13和 Cl2的热化学方程式是_____________________________;上述分解反应是一个可逆反应。温度 Tl时,在密闭容器中加人 0.80 mol PC15,反应达平衡时 PC15还剩 0.60 mol ,其分解率 al等于_________________;若反应温度由 Tl升高到T2,平衡时 PC15的分解率为a2,a2_________ al(填“大于”、“小于”或“等于”) ;
(3)工业上制备 PC15通常分两步进行,先将 P 和 C12反应生成中间产物 PC13,然后降温,再和Cl2反应生成 PCl5。原因是___________________________________
______________________________________________________;
(4)P 和 C12分两步反应生成 1 mol PC15的△H3==__________________,一步反应生成 1 molPC15的△H4____________△H3(填“大于”、“小于”或“等于”)。
(5)PC15与足量水充分反应,最终生成两种酸,其化学方程式是
______________________________________________________________________。