氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一。
(1)传统哈伯法合成氨工艺中相关的反应式为:


 。
。
①该反应的平衡常数K的表达式为:K=_________。升高温度,K值________(填“增大”“减小”或“不变”)。
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1:3)。分析表中数据,__________(填温度和压强)时H2转化率最高,实际工业生产不选用该条件的主要原因是________________。
③下列关于合成氨说法正确是___________(填字母)
A. 使用催化剂可以提高氮气的转化率
B. 寻找常温下的合适催化剂是未来研究的方向
C. 由于△H<0、△S>0,故合成氨反应一定能自发进行
(2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。它既有液氢燃料电池的优点,又克服了液氢不易保存的不足。其装置为用铂黑作为电极,加入电解质溶液中,一个电极通人空气,另一电极通入氨气。其电池反应为
你认为电解质溶液应显______性(填“酸性”、“中性”、“碱性”),写出负极电极反应式________。
(14分)随着石油资源的日趋紧张,天然气资源的开发利用受到越来越多的关注。以天然气(主要成分CH4)为原料经合成气(主要成分CO、H2)制化学品,是目前天然气转化利用的主要技术路线。而采用渣油、煤、焦炭为原料制合成气,常因含羰基铁[Fe(CO)5]等而导致以合成气为原料合成甲醇和合成氨等生产过程中的催化剂产生中毒。
请问答下列问题:
(1)Fe(CO)5中铁的化合价为0,写出铁原子的基态电子排布式
(2)原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为 和 (填化学式),CO分子的结构式可表示成 。
(3)Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可判断Fe(CO)5晶体为 晶体。
(4)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有 ,CH3OH的熔、沸点比CH4的熔、沸点比高,其主要原因是 。
(1)在配合物Fe(SCN)2+中,提供空轨道接受孤对电子的微粒是___________,[Cu(H2O)4]2+名称为,画出该配离子中的配位键_________________。
(2)根据VSEPR预测HCN的空间结构为形,其中C原子用于形成σ键的是个轨道,用于形成π键的是个轨道。
(3)根据甲醛的分子结构特点推测俗称光气的二氯甲醛分子(COCl2)结构式为,中心原子杂化方式为,空间结构为形。
(4)按要求写出仅由第三周期非金属元素的原子构成且中心原子通过sp3杂化形成分子的化学式(各写一种):
正四面体分子_____,三角锥形分子________,V形分子_________。
下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。
| a |
b |
||||||||||||||||
| c |
d |
||||||||||||||||
| e |
f |
g |
h |
i |
|||||||||||||
| j |
|||||||||||||||||
(1)j是钴元素,试画出该元素的原子结构示意图。
(2)c、d原子半径大小cd,第一电离能大小关系是cd,电负性大小关系是cd。(以上填“>”” “<”)
(3)已知NH3·H2O的电离方程式为NH3·H2O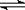 NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是______ (填序号) 。
NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是______ (填序号) 。
(4)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚面离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
①原子核对核外电子的吸引力②形成稳定结构的倾向
下表是一些主族元素的气态原子失去核外不同电子所需的能量(KJ·mol-):
| 锂 |
X |
Y |
|
| 失去第一个电子 |
519 |
502 |
580 |
| 失去第二个电子 |
7296 |
4570 |
1820 |
| 失去第三个电子 |
11799 |
6920 |
2750 |
| 失去第四个电子 |
9550 |
11600 |
表中X、Y可能分别为以上元素中的、(填写元素符号)元素。
分析比较前后两个量的关系(用<或>回答),并给出合理的解释:
(1)元素的第一电离能:S____P,理由是:___________________________________。
(2)物质的沸点:
①SiCl4_____ SiF4,理由是:_____________________________________________。
②HCl______HF,理由是:_________________________________________。
(3)晶体的熔点:
①SiO2_____ CO2,理由是:_______________________________________。
②MgCl2______MgO,理由是:____________________________________。
(4)原子半径:O_____Na,O2—_____Na+,理由是:_____________________________________
830K时,在密闭容器中发生下列可逆反应:
 CO(g)+H2O(g)
CO(g)+H2O(g) CO2(g)+H2(g);△H<0试回答下列问题:
CO2(g)+H2(g);△H<0试回答下列问题: (1)若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=.
(1)若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=. (2)在相同温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态(填“是”与“否”),此时v(正)正)v(逆)(逆)(填“大于”“小于”或“等于”),你判断的依据是。
(2)在相同温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态(填“是”与“否”),此时v(正)正)v(逆)(逆)(填“大于”“小于”或“等于”),你判断的依据是。 (3)若降低温度,该反应的K值将(均填“增大”“减小”或“不变”)。
(3)若降低温度,该反应的K值将(均填“增大”“减小”或“不变”)。