已知A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素。E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子。
(1)基态E原子的价电子排布图 。
(2)B、C、D三元素第一电离能由大到小的顺序为 (用元素符号表示).
(3)BD 中心原子杂化轨道的类型为 杂化;CA4+的空间构型为 (用文字描述)。
中心原子杂化轨道的类型为 杂化;CA4+的空间构型为 (用文字描述)。
(4)1mol B一中含有 键的数目为 NA。
键的数目为 NA。
(5)D、E元素最简单氢化物的稳定性 > (填化学式),理由是 .
(6)C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 ,C原子的配位数是 。若相邻C原子和F原子间的距离为a cm,阿伏伽德罗常数为NA,则该晶体的密度为 g/cm3(用含a、NA的符号表示)。

叶酸是维生素
族之一,可以由下列甲、乙、丙三种物质合成。
(1)甲中显酸性的官能团是(填名称)。
(2)下列关于乙的说法正确的是(填序号)。
a.分子中碳原子与氮原子的个数比是7:5 b.属于芳香族化合物
c.既能与盐酸又能与氢氧化钠溶液反应 d.属于苯酚的同系物
(3)丁是丙的同分异构体,且满足下列两个条件,丁的结构简式为。
a.含有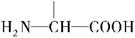 b.在稀硫酸中水解有乙酸生成
b.在稀硫酸中水解有乙酸生成
(4)甲可以通过下列路线合成(分离方法和其他产物已经略去):
①步骤I的反应类型是。
②步骤I和Ⅳ在合成甲过程中的目的是。
③步骤Ⅳ反应的化学方程式为。
焦亚硫酸钠(
)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一焦亚硫酸钠的制取
采用右图装置(实验前已除尽装置内的空气)制取
。装置Ⅱ中有
晶体析出,发生的反应为:

(1)装置I中产生气体的化学方程式为。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为(填序号)。
实验二焦亚硫酸钠的性质
溶于水即生成
。
(4)证明
溶液中
的电离程度大于水解程度,可采用的实验方法是(填序号)。
a.测定溶液的
b.加入
溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验
晶体在空气中已被氧化的实验方案是。
实验三葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用
作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离
计算)的方案如下:
(已知:滴定时反应的化学方程式为
)
①按上述方案实验,消耗标准
溶液25.00
,该次实验测得样品中抗氧化剂的残留量(以游离
计算)为
。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果填"偏高""偏低"或"不变")。
铁及其化合物与生产、生活关系密切。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
①该电化腐蚀称为。
②图中
四个区域,生成铁锈最多的是(填字母)。
(2)用废铁皮制取铁红(
)的部分流程示意图如下:
①步骤I若温度过高,将导致硝酸分解。硝酸分解的化学方程式为。
②步骤Ⅱ中发生反应:
,反应产生的
又将废铁皮中的铁转化为
,该反应的化学方程式为。
③上述生产流程中,能体现"绿色化学"思想的是(任写一项)。
(3)已知t℃时,反应
的平衡常数
=0.25。
①t℃时,反应达到平衡时
=。
②若在1
密闭容器中加入0.02
,并通入
,t℃时反应达到平衡。此时
转化率为50%,则
=。
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是(填序号)。
a.
、
、
的熔点 b.
、
、
的氧化性
c.
、
、
的热稳定性 d.
、
、
的酸性
(3)工业上,通过如下转化可制得
晶体:
溶液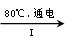 溶液
溶液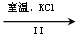 晶体
晶体
①完成I中反应的总化学方程式:□
+□
=□
+□。
②Ⅱ中转化的基本反应类型是,该反应过程能析出
晶体而无其它晶体析出的原因是。
(4)一定条件,在水溶液中1
、
(
=1,2,3,4)的能量(
)相对大小如右图所示。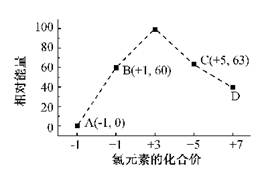
①
是(填离子符号)。
②
反应的热化学方程式为(用离子符号表示)。
用
酸性溶液脱除
后的废液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1
溶液,研究废液再生机理。记录如下(a、b、c代表电压值:)
| 序号 |
电压/V |
阳极现象 |
检验阳极产物 |
| I |
x≥a |
电极附近出现黄色,有气泡产生 |
有 、有 |
| II |
a>x≥b |
电极附近出现黄色,无气泡产生 |
有
、无
|
| III |
b>x>0 |
无明显变化 |
无
、无
|
(1)用KSCN溶液检验出
的现象是。
(2)I中,
产生的原因可能是
在阳极放电,生成的
将
氧化。写出有关反应的方程式。
(3)由II推测,
产生的原因还可能是
在阳极放电,原因是
具有性。
(4)II中虽未检测出
,但
在阳极是否放电仍需进一步验证。电解pH=1的
溶液做对照实验,记录如下:
| 序号 |
电压/V |
阳极现象 |
检验阳极产物 |
| IV |
a>x≥c |
无明显变化 |
有
|
| V |
c>x≥b |
无明显变化 |
无
|
①NaCl溶液的浓度是mol/L。
②IV中检测Cl2的实验方法:。
③与II对比,得出的结论(写出两点):。