下列是三个不同短周期部分元素的原子半径及主要化合价:
| 元素代号 |
W |
R |
X |
Y |
Z |
| 原子半径/nm |
0.037 |
0.154 |
0.066 |
0.070 |
0.077 |
| 主要化合价 |
+1 |
+1 |
-2 |
-3、+5 |
+2、+4 |
试回答下列问题:
(1)五种元素中原子半径最大的元素是 (填元素符号),画出该元素的原子结构示意图: 。
(2)W、X和Y可组成一化合物,其原子个数比为4:3:2,则该化合物属 (填“离子化合物”或“共价化合物”),存在的化学键是 。写出该化合物与由W、R和X按原子个数比为1:1:1组成化合物反应的化学方程式:
。
(3)写出下列反应的化学方程式:
Z的单质与Y元素的最高价氧化物对应的水化物反应: 。
现有室温下浓度均为1×10-3mol/L的几种溶液:
①盐酸、②硫酸、③醋酸、④氯化铵、⑤氨水、⑥NaOH,回答下列问题:
(1)将③、⑥混合后,若溶液呈中性,则消耗两溶液的体积为③ ________ ⑥(填“>”、“<”或“=”)溶液中的离子浓度由大到小的顺序为
(2)将等体积的①、⑤混合,则溶液的pH ________ 7(填“>”、“<”或“=”)
用离子方程式说明其原因 _______________________
(3)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,反应的初始速率由快到慢的为________ (填写序号)
最终产生H2总量的关系为___________(填写序号)
(4)向相同体积的①、③溶液中分别加入相同浓度、相同体积的CH3COONa溶液,充分混合后,混合液的pH 大小关系为① _________ ③(填“>”、“<”或“=”)
(5)将等体积的⑤、⑥溶液加热至同温度后,溶液的pH ⑤ _____ ⑥(填“>”、“<”或“=”)
在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g) C(g)+D(g),最初加入1.0molA和2.2molB,在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
C(g)+D(g),最初加入1.0molA和2.2molB,在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
(1)800℃时,0—5min内,以B表示的平均反应速率为
(2)能判断该反应达到化学平衡状态的依据是
A.容器中压强不变B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
(3)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K=,
该反应为反应(填吸热或放热)
(4)700℃时,某时刻测得体系中各物质的量如下:n(A)=1.1mol,n(B)=2.6mol,n(C)=0.9mol,n(D)=0.9mol,则此时该反应进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)
同素异形体相互转化的反应热相当小而且转化速度较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的观点“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”来研究。已知:
①P4(s、白磷)+5O2(g)=P4O10(s);Δ H=-2983.2 KJ·mol-1
②P(s、红磷)+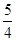 O2(g)=
O2(g)=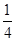 P4O10(s);Δ H=-738.5KJ·mol-1
P4O10(s);Δ H=-738.5KJ·mol-1
试写出白磷转化为红磷的热化学方程式
(7分)CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g) CH3OH(g),达平衡后测得各组分浓度如下:
CH3OH(g),达平衡后测得各组分浓度如下:
| 物质 |
CO |
H2 |
CH3OH |
| 浓度(mol•L-1) |
0.9 |
1.0 |
0.6 |
①混合气体的平均相对分子质量__________________________。
②列式并计算平衡常数K=__________________________。
③若将容器体积压缩为1L,不经计算,预测新平衡中c(H2)的取值范围是__________。
④若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时v正___v逆(填“>”、“<”或“=”)。
(10分) )氮元素有着多变价态和种类繁多的化合物,因在生产、生活中发挥着重要的作用。完成下列问题:
(1)在一密闭容器中,进行如下化学反应:
N2(g)+3H2(g) 2NH3(g) △H<0,其化学平衡常数K与温度T的关系如下表:
2NH3(g) △H<0,其化学平衡常数K与温度T的关系如下表:
| T |
298 K |
398 K |
498 K |
… |
| K |
4.1×106 |
K1 |
K2 |
… |
①比较K1、K2的大小:K1______K2(填“>”、“=”或“<”)。
②若保持容器的容积不变,则该反应达到化学平衡状态的依据是________(填序号)。
A.2v(H2)正=3v(NH3)逆B.v(N2)正=3v(H2)逆
C.容器内压强保持不变 D.混合气体的平均摩尔质量保持不变
③若维持容器的压强不变,达到平衡状态后再向容器中通入一定量的N2,此时逆反应速率______(填“增大”、“减小”或“不变”);平衡常数_____。(填“增大”、“减小”或“不变”)
④已知AgCl可溶于氨水中,而AgBr不溶于氨水中,则Ksp(AgCl)____ Ksp(AgBr) (填“>”、“=”或“<”)。
( 2 )肼是氮元素的另一种氢化物,分子式为N2H4。
①298 K时,1.00 g N2H4(l)与足量的N2O4(l)完全反应生成氮气和水,放出19.15 kJ的热量。写该反应的热化学方程式_____________________________________。
②肼也可以在纯氧中燃烧生成氮气和水,为了充分利用其能量有人设计了原电池装置,电极材料是多孔石墨电极,电解质为能够传导H+的固体电解质,请写出负极反应式____________________。