已知化合物甲和乙都不溶于水,甲可溶于质量分数大于或等于98%的硫酸,而乙不溶。现有一份甲和乙的混合物样品,通过实验进行分离,可得到固体甲。(实验中使用的过滤器是用于过滤强酸性液体的耐酸过滤器)
请填写表中空格,完成由上述混合物得到固体甲的实验设计。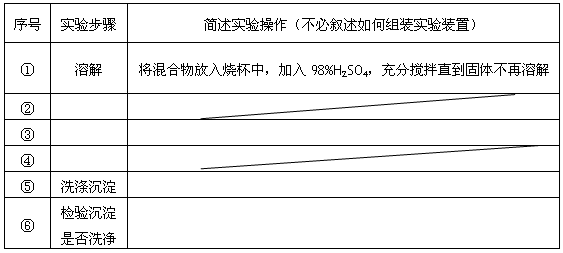
离子反应是中学化学中重要的反应类型。回答下列问题 :
:
(1)在发生离子反应的反应物或生成物中,一定存在________。
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
(2)可用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下图。请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系。

(3)离子方程式是中学生应熟练掌握的化学用语,请写出下列反应的离子方程式:
向Ba(HCO3)2溶液中滴入NaHSO4 溶液,至沉淀完全,反应的离子方程式___________________________。在上述溶液中继续滴入NaHSO4溶液,此时离子方程式为_______________________。
溶液,至沉淀完全,反应的离子方程式___________________________。在上述溶液中继续滴入NaHSO4溶液,此时离子方程式为_______________________。
13分)A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图所示。
⑴若A是淡黄色化合物;D是CO2;C为NaOH。
①写出A的电子式
②写出反应Ⅱ的化学方程式
⑵若A是地壳中含量最多的金属元素的单质,B在火焰上灼烧时火焰呈黄色,E是一种无色无味的气体,遇澄清的石灰水变浑浊。
①写出B的化学式②写出反应Ⅲ的离子方程式
③用单线桥法表示反应Ⅰ电子转移的方向和数目。
如图的甲、乙两容器,甲体积可变压强不变,乙保持体积不变。向两容器中分别充入1 mol A、3 mol B,此时两容器体积均为500 mL,温度为T℃。保持温度不变,发生反应A(g)+3B(g) 2C(g)+D(s);△H<0。
2C(g)+D(s);△H<0。
 (1)下列选项中,能表明甲和乙容器中反应一定达到平衡状态的是________。
(1)下列选项中,能表明甲和乙容器中反应一定达到平衡状态的是________。
A.混合气体的总质量不随时间改变 B.2 v正(C)=3 v逆(B)
C.A、B转化率相等 D. 物质D的质量不随时间改变
(2)2 min后甲容器中的化学反应达到平衡, 测得C
测得C 的浓度为2 mol/L,此时容器的体积为________mL,B的转化率α甲(B)为________。
的浓度为2 mol/L,此时容器的体积为________mL,B的转化率α甲(B)为________。
(3)乙容器中反应 达到平衡所需要的时间______2 min(填“>、<或=”),B的转化率α
达到平衡所需要的时间______2 min(填“>、<或=”),B的转化率α 乙(B) ______α甲(B) (填“>、<或=”)。
乙(B) ______α甲(B) (填“>、<或=”)。
(4)若其它条件不变,甲中如果从逆反应方向开始反应建立平衡,要求平衡时C的物质的量与(2)中平衡时C的物质的量相等,则需要加入C的物质的量n(C)=________mol,加入D的物质的量n (D)应该满足的条件为________________________。
铁及其化合物之间的相互转化可用下式表示:
回答下列有关问题:
(1)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,实现上述①的转化,要求产物纯净,可选用的试剂是________(选填序号)。
a.Cl2 b.Fe c.HNO3 d.H2O2
d.H2O2
(2)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应CuFeS2+4Fe3+=Cu2++5 Fe2++2S(CuFeS2中S为—2价),下列说法正确的是________(选填序号)。
Fe2++2S(CuFeS2中S为—2价),下列说法正确的是________(选填序号)。
a.从物质分类的角度看,黄铜矿属于合金
b.反应中,所有铁元素均被还原
c.反应中,CuFeS2既作氧化剂又作还原剂
d.当转移1 mol电子时,46 g CuFeS2参加反应
(3)下述反应中,若FeSO4和O2的系数比为2︰1,试配平下列方程式:
FeSO4 +K2O2→K2FeO4 +K2O +K2SO4 +O2↑
W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素;W、X各自的最高价氧化物对应的水化物可以反应生成盐和水。
回答下列问题:
(1)W与Y可形成化合物W2Y,该化合物的电子式为:__________________。
(2)比较Y、Z气态氢化物的稳定性:________>________(用分子式表示)。]
(3)W、X、Y、Z四种元素形成的简单离子的离子半径由大到小的顺序是:
________>________>________>________(用离子符号表示)。
(4)下图是WZ晶体的一个“晶胞结构”示意图。
下列说法正确的是________。
| A.与W+ 距离相等且最近的Z— 共有8个 |
| B.与W+ 距离相等且最近的Z— 构成的多面体是八面体 |
| C.与W+ 距离相等且最近的W+ 有8个 |
| D.一个WZ晶胞中含有4个W+ 和4个Z— |
(5)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到一 种稀酸溶液,并放出a KJ的热量。写出该反应的热化学方程式__________________________________。
种稀酸溶液,并放出a KJ的热量。写出该反应的热化学方程式__________________________________。