浓硫酸在实验室可用来干燥Cl2、HCl等气体,这是利用了浓硫酸的__________性。 蔗糖遇浓硫酸变黑,是由于浓硫酸具有__________性。若将盛有浓硫酸的容器敞口放在空气中一段时间后, 其质量会__________(填“增加”、“减少”或“没有变化”)。
在工业上烯烃可以合成多种有机材料.
(1)某同学设计了由乙烯合成合成Y的3条路线(I、II、III)如下图所示.
①3条合成路线中,你认为符合“原子经济”要求的合成路线是(填序号“I”、“II”或“III”)_______.
②X的结构简式是_____________________.
(2)已知Q为乙烯的同系物,以Q和X为原料合成M的方法如下:
请回答下列问题:
①Q的名称是____________
②E中含有官能团的名称是_____________,F的结构简式是___________________.
③写出M与足量氢氧化钠溶液反应的化学方程式______________________.
④已知:
且 
G的同分异构体有多种,写出符合下列条件的G的所有同分异构体______________
a.与钠反应放出氢气
b.在酸性条件下水解为N和乙醇
c.N中含有支链
 (1)一定条件下,在容积为2L的密闭容器中加入一定量的A,发生如下反应并建立平衡:A(g)
(1)一定条件下,在容积为2L的密闭容器中加入一定量的A,发生如下反应并建立平衡:A(g) 2B(g) 2B(g)
2B(g) 2B(g) 2D(g)+C(g)
2D(g)+C(g)
测得平衡时各物质的浓度是:c(A)="0.3" mol·L-1,c(B)="0.2" mol·L-1,c(C)="0.05" mol·L-1,则最初加入的A物质的量是( )
A.0.8 mol B.0.5 mol C.0.9 mol D.1.2 mol
(2)下图为10 mL一定物质的量浓度的HCl溶液用一定物质的量浓度的NaOH溶液滴定的图示.请根据图示计算:
①氢氧化钠物质的量浓度是多少?__________
②A的pH值:__________
(3)已知硼(B)可形成化合物BCl3,该分子的所有原子最外层是否满足八电子稳定结构______(填“是”或“否”).BCl3在潮湿空气中会产生大量白雾,试写出其反应的化学方程式______________________________.
(4)已知锌锰干电池的总式为:Zn+2MnO2+2NH4Cl=Mn2O3+ZnCl2+2NH3+2H2O则该电池的正极反应式为___________________________.
现有四种元素,分别位于元素周期表的前四个不同周期,其原子序数总和为48.由它们可组成甲、乙、丙、丁四种单质和A、B、C、D四种化合物,其中甲、乙为非金属单质,丙、丁为金属单质.这些物质间的转化关系如下图所示(反应条件已省略)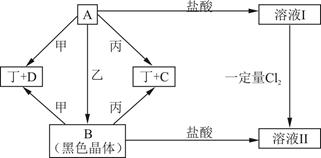
请回答下列问题:
(1)组成丁的元素在周期表中的位置________________.B的俗名_____________,C物质的用途之一_____________________.
(2)写出A+乙 B的化学方程式___________________________________.
B的化学方程式___________________________________.
(3)在加热条件下,丁与气态D可发生反应,该反应的化学方程式为___________.
(4)若21.6g A与适量的乙反应生成B,A、B按上述图示转化为溶液I和溶液II(假设各步反应均恰好进行完全);向溶液I中通入________mol Cl2,经充分反应可恰好使溶质的组成与溶液II完全相同.
 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成
已知:F变成G相当于在F分子中去掉1个X分子。
请回答下列问题:
(1)A与银氨溶液反应有银镜生成,则A的结构简式是。
(2)B →C的反应类型是。
(3)1molG最多能与molNaOH反应。
(4)G的核磁共振氢谱中应有个峰,峰面积比为。
(5)写出E →F的化学方程式。
(6)含苯环、含酯基与D互为同分异构体的有机物有种,写出其中核磁其振氢谱有四个峰,且峰面积比为1﹕2﹕2﹕1有机物的结构简式。
(1)如图所示为冰晶石(化学式为 Na3AlF6)的晶胞。图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽是图中●、○中的一种。图中●、○分别指代哪种粒子、;大立方体的体心处▽所代表的是(用化学式表示)。
Na3AlF6)的晶胞。图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽是图中●、○中的一种。图中●、○分别指代哪种粒子、;大立方体的体心处▽所代表的是(用化学式表示)。
(2)H2S和H2O2的主要物理性质比较如下:
| 熔点/K |
沸点/K |
标准状况时在水中的溶解度 |
|
| H2S |
187 |
202 |
2.6 |
| H2O2 |
272 |
423 |
以任意比互溶 |
H2S和H2O2的相对分子质量基本相同,造成上述物理性质差异的主要原因
。
(3)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有_______(填元素符号)。实验时形成的深蓝色溶液中的阳离子内存在的全部化学键类型有。实验过程中加入C2H5OH后可观察到析出深蓝色Cu(NH3)4SO4·H2O晶体。实验中所加C2H5OH的作用是。