某学生应用下图所示的装置来研究物质的性质,其中气体X的主要成分是氯气,杂质是空气和水蒸气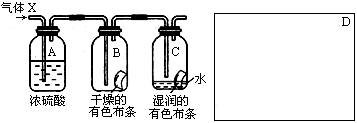
回答下列问题:
(1)该项研究(实验)的主要目的是 。
(2)浓H2SO4的作用是 ,与研究目的直接相关的实验现象是 。
(3)该实验装置设计上存在的缺陷为 ,请在上图的D处画出能克服该缺陷的装置。
(14分)某学生设计了一套验证物质化学性质的实验装置(如图):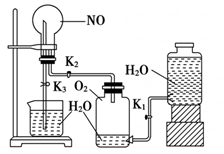
请观察该装置图,完成下列问题:
(1)该实验的目的是。
(2)该实验的涉及的化学方程式有。
(3)实验用品:实验仪器除铁架台(带铁夹)、储气瓶(两个)、直管活塞(K1、K2)、止水夹(K3)、橡胶管、橡胶塞以及若干玻璃管连件外,还有哪几种(写仪器名称)_________________。
(4)实验步骤:①按上图连接好仪器装置;②扭开活塞K1和K2,主要现象为;③关闭,(填写K1或K2或K3)打开,(填写K1或K2或K3), 用手或热毛巾捂住圆底烧瓶,就能使烧瓶产生喷泉。
乙二酸( HOOC—COOH)俗称草酸,易溶于水,,电离常数K1=5.4×10-2,K2=5.4×10-5,其盐草酸钙和草酸氢钙均为白色不溶物。无色晶体H2C2O4·2H2O称为草酸晶体,其熔点为101.5℃。草酸晶体失去结晶水得无水草酸,它在157℃升华。根据上述信息,回答下列问题。
(1)向盛有2mL饱和NaHCO3溶液的试管里加入少量乙二酸浓溶液,观察到有大量气泡产生,写出该反应的离子方程式:。(碳酸:K1=4.4×10-7)
(2)向试管A中加入3mL乙醇,然后边振荡试管边加入2mL浓硫酸和2mL乙二酸溶液,按下图Ⅰ组装好装置,加热3—5min。在装有饱和Na2CO3溶液的试管B中有油状且带有香味的液体产生。B中导管口在液面上而不伸入液面下的原因是。写出乙二酸与少量乙醇反应的化学反应方程式。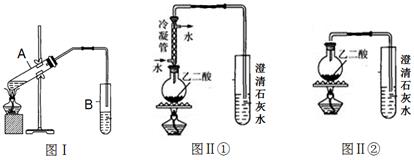
(3)已知草酸分解的化学方程式为:H2C2O4 H2O+CO2↑+CO↑
H2O+CO2↑+CO↑
利用图Ⅱ①和图Ⅱ②加热草酸晶体(夹持仪器忽略),以验证草酸受热是否分解。连续加热一段时间后的现象是:图Ⅱ①:试管里澄清石灰水先变浑浊,后又变澄清;
图Ⅱ②:试管里澄清石灰水只变浑浊。
能验证草酸受热分解的装置是(填图Ⅱ中的编号“①”或“②”)。
(4)图Ⅱ①中冷凝管的作用是:。
实验室中用下列装置制FeCl3,可供选择的试剂有:①MnO2 ②NaOH溶液 ③饱和NaCl溶液 ④浓硫酸 ⑤浓盐酸。
(1)按气体流向由左到右排列,各装置的连接顺序为(填写A—E序号): 。
。
(2)装置连接好后,应该首先进行的实验操作是。
(3)A装置烧瓶中反应的离子方程式是_________________________。
(4)E中盛装的试剂是____________,其作用是。
(5)停止反应后,还有铁丝剩余。为检验FeCl3生成,并最终得到FeCl3溶液,甲同学设计以下实验步骤:
a.待B装置玻璃管冷却后,将管中物质用水溶解, ①除去不溶物;
b.取少量滤液,滴加 ②溶液,溶液呈现红色,以此检验Fe3+;
c.取少量滤液,滴加硝酸酸化的AgNO3溶液,检验Cl-。
①采取的操作方法是;②中所加试剂为。
(6)乙同学认为甲的实验设计不能最终得到FeCl3溶液,其理由是(写出相应的离子反应方程式)。
你认为还选择下列哪些试剂才能制得较为纯净的FeCl3溶液。
| A.KMnO4(H+) |
| B.Fe |
| C.H2O2 |
| D.Cl2 |
E.HNO3
F.盐酸
G.O3
如图是某同学在实验室中进行铝热反应(铝过量)的实验装置,实验中可观察到的现象之一为“纸漏斗的下部被烧穿,有熔融物落入沙中”。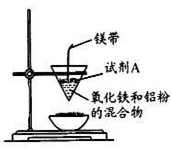
(1)试剂A的名称是。
(2)反应的方程式为。
(3)探究铝热反应后固体的性质:将反应后容器中的残余固体置于烧杯中,加入100mL稀硝酸,固体完全溶解,(假设固体全部溶解后溶液体积不变),反应过程中无气体放出(活泼金属可把稀 HNO3还原为NH4NO3)。向反应后的溶液中缓慢滴加4 mol·L-1的NaOH溶液,产生沉淀的物质的量与加入 NaOH溶液 的体积的关系如图所示: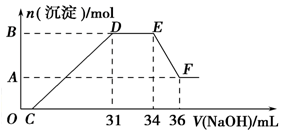
①写出DE段发生反应的离子方程式:________________。
②求c(HNO3)=。
③B与A的差值为________________。
空气吹出法是最早工业上海水提溴的方法,适合从低浓度含溴溶液提取溴。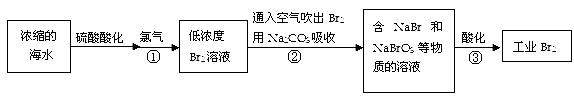
(1)Br2单质的颜色为,NaBr的电子式是。
(2)反应①是将Br— 转化为Br2,则反应①的离子方程式是。
(3)通入空气吹出Br2,并用Na2CO3吸收的目的是。
(4)反应③的离子方程式是,每生成3 mol Br2,转移电子的物质的量是mol。
(5)为了除去工业Br2中微量的Cl2,可向工业Br2中(填字母)。
a.通入HBrb.加入NaBr溶液
c.加入Na2CO3溶液d.加入Na2SO3溶液