二甲醚是重要的有机中间体,利用二氧化碳加氢合成二甲醚能变废为宝,且可替代汽油作为新型清洁燃料。
(1)常温常压下,二氧化碳加氢可选择性生成二甲醚或一氧化碳:
①CO2 (g)+3H2(g)=CH3OH(l)+H2O(l) △H1 =-55.7 kJ/mol
②2CH3OH(l) = CH3OCH3(g)+H2O (l) △H2 =-23.4 kJ/mol
③CO2 (g)+3H2(g) =CO(g) + H2O (l) △H 3>0
则CO2(g)加氢转化为CH3OCH3(g)和H2O (l)的热化学方程式是___________________________________________________。
(2)合成二甲醚往往选用硅铝混合物作催化剂,硅铝比例不同,生成二甲醚或一氧化碳的物质的量分数不同。下图是硅铝比与产物选择性图:
反应③的平衡常数表达式为 ,图中A点和B点的平衡常数比较:KA______KB(填“>、=、<”)。根据以上两条曲线,写出其中一条变化规律: ___________________。
(3)在280oC时,向一个2L的密闭容器中加入等量2mol二氧化碳和氢气, A点二甲醚的浓度为0.15 mol·L-1,计算在A点二氧化碳的转化率,要求写出计算过程。
(4)二甲醚逐渐发展为替代汽油的清洁燃料,在二甲醚燃料电池中,二甲醚通入______极,碱性条件下,该电极反应式是 。
绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)检验制得的绿矾晶体中是否含有Fe3+的实验操作是。
(2)操作II中,通入硫化氢至饱和的目的是;在溶液中用硫酸酸化至pH=2的目的是。
(3)操作IV的顺序依次为:、冷却结晶、。
(4)测定绿矾产品中Fe2+ 含量的方法是:
a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol∙L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①已知KMnO4酸性溶液与Fe2+ 反应时被还原为Mn2+,请写出该反应的离子方程式:;
②计算上述样品中FeSO4∙7H2O的质量分数为(用小数表示,保留三位小数)。
碘是人体必需的微量元素之一,有“智力元素”之称。食用加碘食盐可预防碘缺乏病。查阅资料知:①在酸性条件下,I- 能被NO3- 氧化成IO3-,被H2O2或O2等氧化为I2;② IO3- 能被HSO3- 还原成I2。
请你利用实验室常用仪器和下列限选试剂,依次研究某食盐样品中所加碘的存在形式是I2、I-、IO3- 中的哪一种。
限选试剂如下:1.0 mol∙L-1HNO3溶液、1.0 mol∙L-1H2SO4溶液、1.0 mol∙L-1NaHSO3溶液、3%H2O2溶液、1%淀粉溶液、蒸馏水。
(1)提出假设
假设1:该食盐样品中含I2;
假设2:该食盐样品中含I-;
假设3:。
(2)设计方案与实验探究
将适量食盐样品溶于蒸馏水制成溶液,请按要求填写下表:
| 实验步骤 |
预期现象与结论 |
| 步骤1:取少量上述溶液注入试管中,滴入几滴淀粉溶液,振荡 |
若溶液显(填颜色),则假设1成立;否则,假设1不成立,再进行步骤2 |
| 步骤2: |
若溶液显蓝色,则假设2成立,反应的离子方程式为;否则,假设2不成立,再进行步骤3 |
| 步骤3: |
(3)问题与思考
纯KIO3或纯KI都可以作为食用加碘盐中碘的来源。从化学角度来看,实验中添加(填“KIO3”或“KI”)更好,理由是。
Ⅰ.(1)某兴趣小组甲设计了以下装置和方法测定空气中SO2含量。你认为可行的操作是(填序号)
| 序号 |
A |
B |
C |
| 装置 |
 |
 |
 |
| 原理 |
通入V升空气,测定生成沉淀的质量 |
当KMnO4溶液刚好褪色时,测定通入空气的体积V |
通入V升空气,测定U型管增加的质量 |
(2)兴趣小组乙取336mL(标准状况)某由SO2和N2组成的混合气体Y,将其通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由此推知气体Y中SO2的体积分数为。
Ⅱ某化学兴趣小组丙为探究Fe3+是否能氧化SO2,设计了如下实验装置。
(1)如上图连接好装置。实验前应进行操作
(2)观察到装置C中产生了白色沉淀,同学们提出了以下猜想(每个猜想只考虑一种物质的氧化性)。
猜想1:;
猜想2:SO2被Fe3+氧化了;
猜想3:SO2被NO3—氧化了
(3)甲同学认为猜想1正确,并利用上述装置A进行了排除干扰的探究实验。
(4)乙同学认为猜想2正确,则装置C中反应的离子方程式是
(5)丙同学认为猜想3正确,他利用甲同学的实验装置,设计实验验证猜想。请在答题卡上写出实验步骤以及预期现象和结论。限选实验试剂:NaNO3溶液、KSCN溶液、FeCl3溶液、BaCl2溶液、
| 实验步骤 |
预期现象和结论 |
Fe(NO3)3溶液
某化学兴趣小组的同学用下图所示实验装置进行实验研究(图中a、b、c表示止水夹),请对其方案进行完善或评价。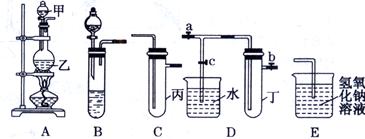
(1)实验室将B、C、E相连后,以浓盐酸和为原料可制取Cl2。
(2)利用实验室常用方法制取氯气,将A、C、E相连,在丙中加入适量水,即可制得氯水.将所得氯水分为两份,进行Ⅰ、Ⅱ两个实验,实验操作如下,将现象①填入下表:
| 实验 序号 |
实验操作 |
现象 |
| Ⅰ |
将氯水滴入品红溶液 |
① |
| Ⅱ |
氯水中加入碳酸氢钠粉末 |
有无色气泡产生 |
②请你评价:
实验Ⅱ推出相应的结论是氯气与水反应的产物具有酸性,是否合理? ________________若不合理,请说明理由(若合理,无需填写):________________________________________。
(3) A、C、E相连,可设计一个简单的实验,以验证Cl-和Br-的还原性强弱,C中应放入的试剂是。
(4) B、D、E装置相连后,在B中盛装浓硝酸和铜片,可制得NO2,欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹________,再打开止水夹c,双手紧握(或微热)试管丁,使试管中气体逸出,NO2与水接触后观察到的现象是。
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下: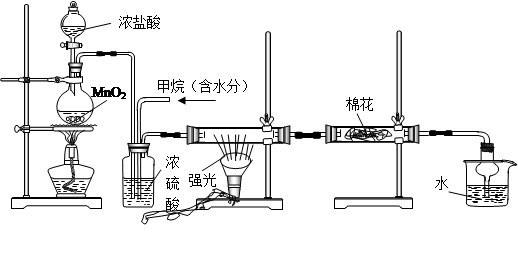
A B C D E
(1)写出A装置中发生反应的离子方程式
(2)B装置主要有三种功能:①②③均匀混合气体;
(3)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x的值应≥
(4)D装置中棉花上均匀滴有足量淀粉KI浓溶液,其作用是,一段时间后发现
棉花由白色变为色。
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出反应的化学方程式。
(6)E装置中使用球形干燥管的作用是
(7)E装置中除盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为(填字母)。
| A.分液法 | B.蒸馏法 | C.过滤 | D.结晶法 |