下列装置为中学化学实验常用的气体制备装置


A B C
(1)若用NaHCO3和稀盐酸制取二氧化碳,应选择装置 。
(2)若用NH4Cl和碱石灰制取NH3,应选择装置 。
(3)若用高锰酸钾和浓盐酸不加热制取Cl2,应选择装置 。
(4)①某研究性小组查阅资料得知,漂白粉与硫酸溶液反应可制的氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4="2" CaSO4+2 Cl2+2H2O应选择装置 。
②为证明氯气具有氧化性将氯气分别通入到亚硫酸钠溶液和氯化亚铁溶液中,设计实验证明亚硫酸钠已经被氧化 。
写出氯气和氯化亚铁溶液反应的离子方程式: 。
③请写出氯气尾气处理的离子方程式 。
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。请回答:
(1)浓硫酸的作用是。
(2)球形干燥管C的作用是。若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是;反应结束后D中的现象是。
下列有机实验操作或叙述中正确的是(填写代号)。
| A.制取酚醛树脂的实验中,水浴加热时不必用温度计 |
| B.苯和浓溴水反应可制溴苯 |
| C.验证蔗糖水解产物时,在蔗糖溶液中加几滴稀硫酸,水浴5min,加入新制银氨溶液 |
| D.向鸡蛋清溶液中滴入浓硝酸,会有白色沉淀产生,微热会产生黄色物质 |
E.在植物油中滴入溴水,溴水会褪色
F.实验室制肥皂时,将适量植物油、乙醇和NaOH溶液混合,并不断搅拌、加热,直到混合物变稠,即可得到肥皂
从海水中可以获得淡水、食盐,并可提取镁和溴等物质。
(一)海水淡化的方法主要有(填一种)
(二)从海水中提取溴和镁的流程如下图所示:
(1)提取Br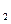 时第一次通入Cl
时第一次通入Cl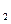 后发生反应的离子方程式是;②中表现
后发生反应的离子方程式是;②中表现 表现(填“氧化”或“还原”)性;
表现(填“氧化”或“还原”)性;
第二次通入Cl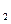 后,要提取Br
后,要提取Br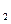 还要进行的操作为。
还要进行的操作为。
(2)为了实现对镁离子的富集,①中加入的足量试剂是(填化学式);
试从节约能源,提高金属镁的纯度分析,以下最适宜的冶炼的方法是(填字母)。
在试管A中加入3mL乙醇,然后边振荡试管边慢慢加入2mL乙醇,按右图所示连接好装置进行实验,以制取乙酸乙酯。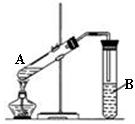
(1)试管B中盛放的试剂是;反应中浓硫酸的作用是。
(2)乙醇与乙酸反应的化学方程式是。
(3)B中的导管不能插入液面以下的原因是。
(4)儿童30g乙酸与46g乙醇反应,如果实际产率是理论产率的60%,则可得到的乙酸乙酯的质量是g。
根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量Ar(Cu)(近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H2O),同时生成有一种对环境无害的气体,由此计算Ar(Cu)。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4C1与Ca(OH)2的量足以产生使CuO完全还原的氨气):
请回答下列问题:
(1)检验装置A的气密性的方法是
。
(2)装置A中发生反应的化学方程式为,氨气还原炽热氧化铜的化学方程式为。
(3)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)a→。
(4)在本实验中,若测得m(CuO)=ag,m(H2O)=bg,则Ar(Cu)=。
(5)在本实验中,使测定结果Ar(Cu)偏大的是_______________(填序号)。
①CuO未完全起反应 ②CuO不干燥③CuO中混有不反应的杂质
④碱石灰不干燥 ⑤NH4C1与Ca(OH)2混合物不干燥
(6)在本实验中,还可通过测定______________和_____________,或_______________和_______________达到实验目的。