黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其燃烧产物为SO2和Fe2O3。
(1)已知1g FeS2完全燃烧放出7.1kJ热量,则表示FeS2完全燃烧反应的热化学方程式为:
______________________________________________________________。
(2)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g) 2SO3(g) 在一定条件下达到平衡,测得c(SO3)=0.040mol/L。则该条件下反应的平衡常数K的数值为___________,SO2的平衡转化率为__________。
2SO3(g) 在一定条件下达到平衡,测得c(SO3)=0.040mol/L。则该条件下反应的平衡常数K的数值为___________,SO2的平衡转化率为__________。
(3)当该反应处于平衡状态时,欲使平衡向正反应方向移动且反应速率加快,下列措施可行的是 。(填字母)
| A.向平衡混合物中充入Ar | B.向平衡混合物中充入O2 |
| C.改变反应的催化剂 | D.降低反应的温度 |
(4)反应:2SO2(g)+O2(g) 2SO3(g) △H<0 , SO2的转化率在起始温度T1=673K下随反应时间(t)的变化如下图,其他条件不变,仅改变起始温度为T2=723K,请在图中画出温度T2下SO2的转化率随反应时间变化的预期结果示意图。
2SO3(g) △H<0 , SO2的转化率在起始温度T1=673K下随反应时间(t)的变化如下图,其他条件不变,仅改变起始温度为T2=723K,请在图中画出温度T2下SO2的转化率随反应时间变化的预期结果示意图。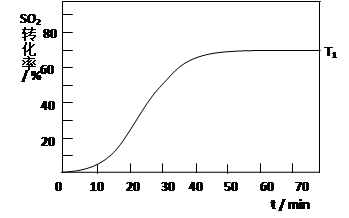
I.氮及其化合物在很多方面有重要的用途。
(1)氮的氧化物有多种。现有NO和NO2的混合气体,其中N 、O元素质量之比为7:12,则该混合气中NO和NO2的物质的量之比为 。
(2)氨气的实验室制法有多种,若不加热,制取氨气所用试剂可以用浓氨水和氢氧化钠固体,产生氨气的原因是: ;氨气的检验方法是: 。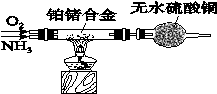
通过如图装置(尾气处理装置已略去)验证了氨有还原性,硬质玻璃管中氨发生催化氧化反应的化学方程式为_________________________。
(3)氮的一种氢化物肼(即N2H4)用作发射卫星的燃料。
已知: N2+2O2=2NO2 N2H4+O2=N2 +2H2O
发射卫星用气体肼为原料,以NO2气体为氧化剂。若1 g气体肼与NO2气体反应生成氮气和水蒸气放出a kJ热量,写出反应的热化学方程式______________________。反应中生成N2质量为42g,则转移电子的物质的量为________________。
II.已知在常温常压下:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H=-1275.6 kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0 kJ/mol
③H2O(g)=H2O(l)△H=-44.0 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 。
I.X、Y、Z、M、N为短周期的五种主族元素,其中X、Z同主族,Y、Z同周期,M与X,Y既不同族,也不同周期。X原子最外层电子数是核外电子层数的三倍,Y的最高化合价与其最低化合价的代数和等于6。N是短周期主族元素中原子半径最大的非金属元素。
(1)请写出M的元素符号: ____________,Z的原子结构示意图: ____________。M与X两元素可形成两种液态化合物,其化学式分别为 。
(2)请写出N元素在周期表中的位置 ;与N同族的短周期元素L,其最高价氧化物的电子式为 。
(3)Y与Z相比,非金属性较强的元素是___,(填元素符号)可以证明该结论的实验事实是 。
II.下列转化关系中,X、Y是生活中用途广泛的两种金属单质,A、B是氧化物,A为红棕色固体,C、D、E是中学常见的三种化合物。分析转化关系回答问题。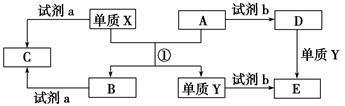
(1)请写出反应①的化学方程式:________________________________。
(2)由D到E的离子方程式_________________________________。
(3)若试剂a是NaOH溶液,写出单质X与NaOH溶液反应的离子方程式 。
(4)若试剂b是H2SO4,工业上用E、H2SO4和NaNO2为原料制取高效净水剂Y(OH)SO4,已知还原产物为NO,则该反应的化学方程式是________________________________。
(5)工业上电解熔融的B制取X时,若阳极产生的气体在标准状况下的体积为33.6 L,则阴极产物的质量为______________。
某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等。水垢会形成安全隐患,需及时清洗除去。清洗流程如下:
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸和少量NaF溶液,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
(1)用NaOH溶解二氧化硅的化学方程式是 。
(2)已知:20℃时溶解度/g
| CaCO3 |
CaSO4 |
Mg(OH)2 |
MgCO3 |
| 1.4×10-3 |
2.55×10-2 |
9×10-4 |
1.1×10-2 |
根据数据,结合化学平衡原理解释清洗CaSO4的过程 。
(3)在步骤Ⅱ中:
① 被除掉的水垢除铁锈外,还有 。
② 清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因 。
(4)步骤Ⅲ中,加入Na2SO3的目的是 。
(5)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe2O3保护膜。
① 完成并配平其反应的离子方程式:
②下面检测钝化效果的方法合理的是 。
a.在炉面上滴加浓H2SO4,观察溶液出现棕黄色的时间
b.在炉面上滴加酸性CuSO4溶液,观察蓝色消失的时间
c.在炉面上滴加酸性K3[Fe(CN)6]溶液,观察出现蓝色沉淀的时间
d.在炉面上滴加浓HNO3,观察出现红棕色气体的时间
综合利用CO2对环境保护及能源开发意义重大。
(1)Li2O、Na2O、MgO均能吸收CO2。如果寻找吸收CO2的其他物质,下列建议合理的是____。
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
(2)Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:在500℃时,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行放出CO2,Li4SiO4再生,说明该原理的化学方程式是____________________________________________。
(3)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:CO2+H2O  CO+H2+O2
CO+H2+O2
已知: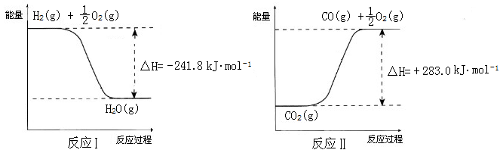
则反应A的热化学方程式是___________________________________________________。
(4)高温电解技术能高效实现(3)中反应A,工作原理示意图如下: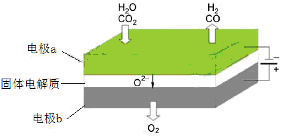
① 电极b发生 (填“氧化”或“还原”)反应。
②CO2在电极a放电的反应式是___________________________。
(1)对工业合成氨条件的探索一直是化学工业的重要课题,在恒温恒容的甲容器、恒温恒压的乙容器中分别进行合成氨反应,如下图(图中所示数据均为初始物理量)。t分钟后反应均达到平衡,生成的NH3均为0.4mol(忽略水对压强的影响及氨气的溶解)。
T=a℃ V=2L T=a℃ V=2L移动活塞
①判断甲容器中的反应达平衡的依据是 。(填写相应编号)
| A.压强不随时间改变 |
| B.气体的密度不随时间改变 |
| C.c(N2)不随时间改变 |
| D.单位时间内生成2 mol NH3的同时消耗1 mol N2 |
E.单位时间内断裂3 mol H-H键,同时断裂6 mol N-H键
②该条件下甲容器中反应的平衡常数K= ;平衡时,甲的压强P平= (用初始压强P0表示)。
(2)最近华南理工大提出利用电解法制H2O2并用产生的H2O2处理废氨水,装置如图所示。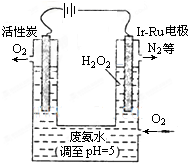
①为了不影响H2O2的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中c(NH4+)_________c(NO3-)(填“>”、“<”或“=”)。
②Ir-Ru惰性电极有吸附O2作用,该电极上的反应为 。
③理论上电路中每转移3 mol电子,最多可以处理NH3·H2O的物质的量为 。