无水氯化铝是有机化工常用催化剂,其外观为白色固体,178℃时升华,极易潮解,遇水后会发热并产生白雾。实验室用如下装置制备少量无水氯化铝,其反应原理为: 2Al+ 6HCl(g) → 2A1Cl3 + 3H2。
完成下列填空:
(1)写出烧瓶中(B处)发生反应的化学方程式:_____________
(2)C中盛有的试剂为_____。进行实验时应先点燃_____(选填“B”或“D”)处酒精灯。
(3)用粗短导管连接D、E的目的是_______ (选填序号)。
a.防堵塞 b.防倒吸 c.平衡气压 d.冷凝回流
E瓶的作用是_______。
(4)F中盛有碱石灰,其目的是_______(选填序号)。
a.吸收HCl b.吸收Cl2 c.吸收CO2 d.吸收H2O
(5)将D中固体改为市售氯化铝(AlCl3·6H2O)也能进行无水氯化铝的制备,此时通入HCl气体的目的是_______。若实验条件控制不当,最终得到的物质是碱式氯化铝[化学式为Al2(OH)nCl(6-n)],且质量是原市售氯化铝的40%,则可推算n的值为_______。
(6)有人建议将上述装置A、B中的试剂改为浓盐酸和二氧化锰,其余装置和试剂均不变, 也能制备无水AlCl3。事实证明这样做比较危险,请简述理由_______
某氧化铁样品中含有少量的FeCl2杂质。现要测定其中铁元素的质量分数,按以下步骤进行实验:
请根据图的流程,回答下列问题:
⑴操作I的目的为配制250.00ml样品溶液,则所用到玻璃仪器除烧杯、玻璃棒、胶头滴管以外,还必须有(填仪器名称);操作II必须用到的仪器是。(填字母)
| A.50ml烧杯 | B.50ml量筒 | C.100ml量筒 | D.25ml滴定管 |

⑵再加入氨水的离子方程式为。
⑶检验沉淀是否洗涤干净的操作是
。
⑷将沉淀物加热,冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1—b2=0.3,则接下来还应进行的操作是。
⑸若坩埚的质量为W1g,坩埚与加热后固体的总质量为W2g,则样品中铁元素的质量分数是。
⑹有学生认为上述实验步骤太繁琐,他认为,将样品溶于水后充分搅拌,在空气中加热蒸干燃烧称量即可,请你评价是否可行?。(填“可行”或“不可行”)
四只试剂瓶中分别盛装有NaNO3溶液、Na2CO3溶液、Na2SO4溶液和NaCl溶液,通过如下实验可以鉴别出该四种溶液,请根据实验步骤填写下列空白:
在四支试管中分别取四种溶液各1mL,。
(1)在四支试管中分别滴入,出现现象的是,离子方程式是。
(2)在剩余三支试管中分别滴入,出现现象的是,离子方程式是。
(3)在剩余两支试管中分别滴入,出现现象的是,离子方程式是。三次实验中都没有明显现象的是。
用下面方法可以制得白色的Fe(OH)2沉淀。
用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入
________________________________________________________________________。
(2)除去蒸馏水中溶解的O2常采用________的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是
________________________________________________________________________。
某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如下图所示。
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的的是(填装置序号) 。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为________________________________________________________________________;
与实验Ⅲ相比,实验Ⅳ的优点是(填选项序号)________;
| A.Ⅳ比Ⅲ复杂 |
| B.Ⅳ比Ⅲ安全 |
| C.Ⅳ比Ⅲ操作简便 |
| D.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行 |
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是(填化学式)________。
甲、乙两同学欲制取纯净的Fe(OH)2 ,根据如图所示的装置进行试验。A管中是Fe+H2SO4, B管中是NaOH溶液,请回答下列问题。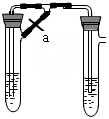
A B
(1)同学甲:先夹紧止水夹a,使A管开始反应,在B管中观察到的现象是 。
(2)同学乙:打开a,使A管中反应一段时间再夹紧止水夹a,实验中在B管中观察到的现象是 ,
B中发生反应的离子方程式为
(3)同学乙打开a的目的 , (填甲或乙)同学可成功。