S2C12是一种金黄色易挥发的液体,常用作橡胶硫化剂。某化学兴趣小组拟设计实验制备少量的S2C12,査阅资料知S2Cl2在水中易发生歧化反应(一部分硫元素化合价升高,另一部分化合价降低)。加热条件下硫单质和干燥、纯净的Cl2反应即可生成S2C12,反应的化学方程式为:2S+Cl2 S2Cl2。
S2Cl2。
反应涉及的几种物质的熔沸点如下:
| 物质 |
S |
S2Cl2 |
| 沸点/℃ |
445 |
138 |
| 熔点/℃ |
113 |
-76 |
该小组设计的制备装置如下图(夹持仪器已略去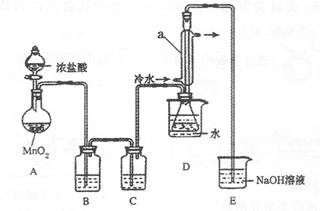
回答下列问题:
(1)连接好实验装置后的第一步实验操作是______。
(2)实验中需要加热的仪器是______。(填写字母)
(3)装置B、C中的试剂分别是______。
(4)装置D中仪器a的作用是______。
(5)反应结束后从锥形瓶内混合物中分离出产品的方法是____________。
(6)若实验过程中缺少C装置,发现产品浑浊不清,请用化学方程式表示其原因____________
(7)实验完毕,小组中的一位同学把剩余浓盐酸倒入E烧杯中,发现有黄绿色剌激性气体产生。用离子方程式表示产生该现象的原因____________。
I.某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表。
| 实验方案 |
实验现象 |
| ①用砂纸擦后的镁带与沸水反应,再向反应后溶液中滴加酚酞 |
(A)浮于水面,熔成一个小球,在水面上无定向移动,随之消失,溶液变红色 |
| ②向新制的H2S饱和溶液中滴加新制的氯水 |
(B)产生气体,可在空气中燃烧,溶液变成浅红色 |
| ③钠与滴有酚酞试液的冷水反应 |
(C)反应不十分强烈,产生的气体可以在空气中燃烧 |
| ④镁带与2 mol·L-1的盐酸反应 |
(D)剧烈反应,产生可燃性气体 |
| ⑤铝条与2 mol·L-1的盐酸反应 |
(E) 生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告:
(1)实验目的:探究同周期元素的金属性和非金属性的递变规律。
(2)实验用品:
仪器:①试管②酒精灯③胶头滴管④试管夹⑤镊子⑥小刀⑦玻璃片⑧砂纸⑨烧杯等。
药品:钠、镁带、铝条、2 mol·L-1的盐酸、新制的氯水、饱和的H2S溶液等。
(3)实验内容:(填写与实验方案相对应的实验现象)
①②③④⑤(用A-E表示)
写出③的离子方程式。
(4)实验结论:。
II. 实验室利用如图装置进行中和热的测定,请回答下列问题:
(1)从实验装置上看,图中尚缺少一种玻璃仪器是。
(2)做1次完整的中和热测定实验,温度计需使用次。
(3)某同学为了省去清洗温度计的麻烦,建议实验时使用两支温度计分别测量酸和碱的温度,你是否同意该同学的观点,为什么?
某化学学习小组欲设计一套实验装置来电解饱和食盐水,并测量电解产生的氢气的体积(预计H2的体积6mL左右)同时检验氯气的氧化性。现有以下的仪器可供选择:
(1)若要完成以上的实验,将所给仪器连成一整套装置,各种仪器接口的连接顺序(填编号)是:
A接、接,B 接、接。
( 2)能说明氯气具有氧化性的实验现象是。
(3)已知氯气溶于水中有如下平衡:Cl2+H2O HC1+HC1O。常温下在一个容积为50mL的针筒(如图所示,活塞可自由滑动,针筒上有刻度)里吸入40mLCl2和l0mL H2O。
HC1+HC1O。常温下在一个容积为50mL的针筒(如图所示,活塞可自由滑动,针筒上有刻度)里吸入40mLCl2和l0mL H2O。
①若将此针筒长时间放置在有日光的地方,最终可能观察到的现象是。
②用化学平衡的观点解释①的现象:
(4)假定装入的饱和食盐水为50mL(电解前后溶液体积变化可忽略),当测得的氢气为5.6mL(标准状况)时停止通电。摇匀U形管内的溶液后溶液的pH约为____。
某化学反应2A(g)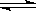 B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表: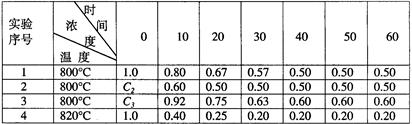
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为mol/(L·min)。
(2)在实验2,A的初始浓度C2=mol/L。
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3V1(填>、=、<)且C31.0mol/L(填>、=、<)
(4)比较实验4和实验1,可推测该反应是反应(选填吸热、放热)。
用50mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: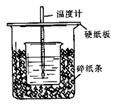
(1)从实验装置上看,图中尚缺少的一种玻璃仪器的名称是。
(2)烧杯间填满碎纸条的作用是。
(3)大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大、偏小、无影响”)
(4)如果用60mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等、不相等”),所求中和热(填“相等、不相等”)。
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下: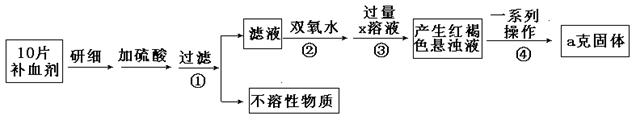
请回答下列问题:
(1)步骤②加入过量H2O2的目的:
(2)步骤③中反应的离子方程式:
(3)步骤④中一系列处理的操作步骤:过滤、、灼烧、、称量。
(4)若实验无损耗,则每片补血剂含铁元素的质量g(用含a的代数式表示,不用化简)。
(5)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。
(5Fe2+ + MnO4— + 8H+= 5Fe3+ + Mn2+ + 4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需__________________。
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是____________。
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸