在容积为2L的密闭容器中进行反应:CO(g)+2H2(g) CH3OH(g) ,其他条件不变,在300℃和500℃时,甲醇物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是( )
CH3OH(g) ,其他条件不变,在300℃和500℃时,甲醇物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是( )
| A.该反应的△H>0 |
| B.其他条件不变,升高温度反应的平衡常数增大 |
C.300℃时,0-t 1min内 CH3OH的平均生成速率为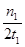 mol·L-1 min-1 mol·L-1 min-1 |
D.A点的反应体系从300℃升高到500℃,达到平衡时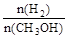 减小 减小 |
向一恒容密闭容器中充入2 mol SO2和1mol O2,在一定条件下发生反应:2SO2+O2 2SO3,下列有关说法正确的是
2SO3,下列有关说法正确的是
| A.达到化学平衡时,正反应和逆反应的速率都为零 |
| B.当O2的浓度不变时,反应达到平衡状态 |
| C.当单位时间消耗a mol O2,同时消耗2a mol SO2时,反应达到平衡状态 |
| D.当SO2、O2、SO3的分子数比为2:1:2,反应达到平衡状态 |
下列关于苯的叙述正确的是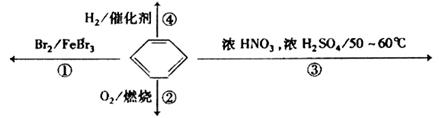
| A.反应①为取代反应,有机产物的密度比水小 |
| B.反应②为氧化反应,反应现象是火焰明亮并带有较多的黑烟 |
| C.反应③为取代反应,有机产物是一种烃 |
| D.反应④中1mol苯最多与3 mol H2发生加成反应,是因为苯分子含有三个碳碳双键 |
把甲、乙、丙、丁四块金属泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若甲、乙相连,甲为负极;丙、丁相连,丁上有气泡逸出;甲、丙相连,甲上发生氧化反应;乙、丁相连,乙是电子流入的一极。则四种金属的活泼性顺序由大到小排列为
| A.甲>乙>丙>丁 | B.甲>丙>乙>丁 | C.甲>丙>丁>乙 | D.乙>丁>丙>甲 |
用NA表示阿伏加德罗常数,下列叙述中正确的是
| A.标准状况下,22.4L乙醇完全燃烧后生成CO2的分子数为2NA |
| B.56g的铁发生氧化还原反应,一定失去3NA个电子 |
| C.标准状况下,22.4L氧气和二氧化碳混合气体中所含氧原子数为2NA |
| D.0.1mol/L稀硫酸中含有SO42—离子数为0.1NA |
汽车尾气中的有毒气体NO和CO,在一定条件下可发生反应生成N2和CO2。下列关于此反应的说法中,正确的是
| A.减小压强能增大反应速率 | B.增大压强能减小反应速率 |
| C.使用适当的催化剂能增大反应速率 | D.升高温度对反应速率无影响 |