钒及化合物用途广泛。工业上常用含少量Al2O3的钒铁矿(FeO×V2O5)碱熔法提取V2O5。简要工艺流程如下:
已知:①焙烧时可发生反应:V2O5+Al2O3+2Na2CO3 2NaVO3+2NaAlO2+2CO2↑
2NaVO3+2NaAlO2+2CO2↑
②常温下物质的溶解度:NaVO3~21.2 g /100g水;HVO3~0.008 g/100g水
(1)“浸出渣B”的主要成分是 。(写化学式)
(2)生产中,不直接用H2SO4浸泡“烧渣A”获取HVO3的原因是 。
(3)“操作①”包括 、洗涤。如果不洗涤,则产品中可能含有的金属阳离子是 、 。下列装置(部分夹持仪器省去)可用在实验室进行“操作②”的是 。(填序号)
A B C D
(4)NaVO3用于原油的脱硫技术,由V2O5溶于NaOH溶液中制取,反应的离子方程式为 。
(5)V2O5还可用于将硅铁炼成钒铁。生产中加入CaO可节能减排。有关反应如下:
2V2O5(l)+ 5Si(s)+ 5CaO(s)=" 4V(s)+" 5CaSiO3(s) △H1 =" —2096.7" kJ/mol
已知:CaSiO3(s)=" CaO(s)+" SiO2(s) △H2 =" +92.5" kJ/mol
则:2V2O5(l)+ 5Si(s)=" 4V(s)+" 5SiO2(s) △H3 = 。
某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示。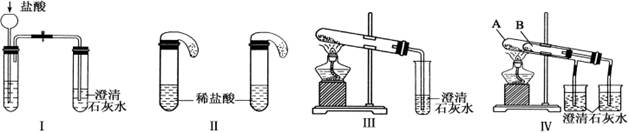
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的的是(填装置序号)________;
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其都能发生的反应的化学方程式为_____________
_______________;与实验Ⅲ相比,实验Ⅳ的优点是_________________________;
(3)有同学认为,除上述试验方法外,向两种固体配成的溶液中加入澄清石灰水也可以区分它们,这种说法是_____________(填“正确”或“错误”)的。
(4)另有两瓶溶液,已知分别是K2CO3和NaHCO3,请你写出两种不同的鉴别方法。
①______________________________________;②________________________________。
(15 分) 亚氯酸钠(NaClO2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌。以下是制取亚氯酸钠的工艺流程: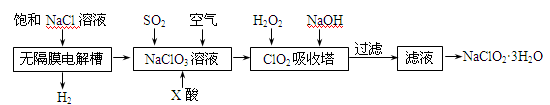
已知:①NaClO2的溶解度随着温度升高而增大,适当条件下可结晶析出。
②ClO2气体只能保持在稀释状态下以防止爆炸性分解,且需现合成现用。
③ClO2气体在中性和碱性溶液中不能稳定存在。
(1)在无隔膜电解槽中持续电解一段时间后,生成氢气和NaClO3,请写出阳极的电极反应方程式:。
(2)反应生成ClO2气体需要X酸酸化的原因为:。X酸为。
(3)吸收塔内的温度不能过高的原因为:
(4)吸收塔内ClO2随着还原剂的不同和溶液酸碱性的变化可被还原为ClO2—或Cl—。ClO2被S2—还原为ClO2—、Cl—的转化率与溶液pH的关系如右图所示。
请写出pH≤2时ClO2与S2—反应的离子方程式:。
(5)第二步向NaClO3溶液中通SO2的同时通入空气的原因为:。
(6)从滤液中得到NaClO2·3H2O粗晶体的操作步骤为
、、。
(15 分) S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的反应原理有两种:
① CS2+3Cl2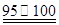 ℃CCl4+S2Cl2;② 2S+Cl2
℃CCl4+S2Cl2;② 2S+Cl2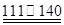 ℃S2Cl2。
℃S2Cl2。
已知:S2Cl2易与水反应,S2Cl2+Cl2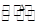 2SCl2。
2SCl2。
下列是几种物质的熔沸点和反应装置图
| 物质 |
沸点/℃ |
熔点/℃ |
| S |
445 |
113 |
| CS2 |
47 |
-109 |
| CCl4 |
77 |
-23 |
| S2Cl2 |
137 |
-77 |
(1)利用上图装置(部分夹持仪器已略去)来制备S2Cl2,反应原理是(填写以上两种反应原理的数字序号)
(2)若装置C更换成干燥管,则装置C中可选用的固体试剂是。
(3)D装置中冷凝管的作用是;反应结束后,将D装置锥形瓶内的混合物中分离出产物的方法是。
(4)S2Cl2与足量水反应有黄色沉淀生成,产生的无色气体能使品红溶液褪色,则该反应的化学方程式为。
(5)为了提高制得的产品S2Cl2的纯度,关键的操作是控制好温度和。
(6)上图尾部装置不够完善,存在的问题是。
(12 分)以电石渣[主要成分是Ca(OH)2,含SiO2、Al2O3以及其它少量杂质]为原料生产氯酸钾联产碳酸钙的流程如下: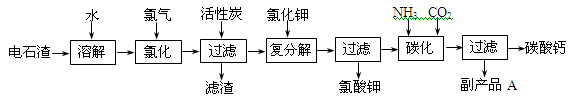
回答下列问题:
(1)电石渣溶于水形成电石渣浆时发生的主要反应的化学方程式为:
_____________________________________、__________________________________。
(2)氯化过程的温度控制在75~80℃,该过程主要反应的化学方程式为:
________________________________________________________________________。
(3)该流程中加入活性炭的作用是_____________________________________________。
(4)该流程中碳化反应的离子方程式为_________________________________________。
(5)副产品A的化学式为________________。
维生素C是一种水溶性维生素(其水溶液呈酸性),它的化学式是C6H8O6,人体缺乏这样的维生素能得坏血症,所以维生素C又称抗坏血酸。在新鲜的水果、蔬菜、乳制品中都富含维生素C,例如新鲜橙汁中维生素C的含量在500mg/L左右。十二中某研究性学习小组测定了某品牌软包装橙汁中维生素C的含量,下面是他们的实验分析报告。
(一)测定目的:测定×××牌软包装橙汁中维生素C的含量。
(二)测定原理:C6H8O6+I2 →C6H6O6+2H++2I―
(三)实验用品及试剂
(1)仪器和用品(自选,略)
(2)试剂:指示剂_________(填名称,1分),浓度为8.00×10-3mol·L-1的I2标准溶液、蒸馏水等。
(四)实验过程
(3)洗涤仪器,检查滴定管是否漏液,润洗相关仪器后,装好标准碘溶液待用。
(4)用________________(填仪器名称,1分)向锥形瓶中移入20.00mL待测橙汁,滴入2滴指示剂。
(5)用左手控制滴定管的____________(填部位,1分),右手摇动锥形瓶,眼睛注视___________,直到滴定终点。滴定至终点时的现象是________________。
(五)数据记录与处理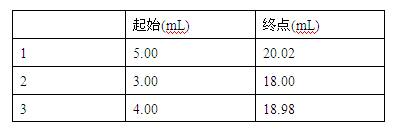
(6)若经数据处理,则此橙汁中维生素C的含量是____________mg/L。
(六)问题讨论
(7)从分析数据看,此软包装橙汁是否是纯天然橙汁?_______(填“是”或“不是”或“可能是”,1分)。生产商最可能采取的做法是__________(填编号,1分):
A.加水稀释天然橙汁 B.将维生素C作为添加剂 C.橙汁已被浓缩