目前工业合成氨的原理是:N2(g)+3H2(g) 2NH3(g) △H=-93.0kJ /mol;另据报道,一定条件下:2N2(g)+6H2O(l)
2NH3(g) △H=-93.0kJ /mol;另据报道,一定条件下:2N2(g)+6H2O(l) 4NH3(g)+3O2(g) △H=" +1530.0kJ" /mol。
4NH3(g)+3O2(g) △H=" +1530.0kJ" /mol。
(1)氢气的燃烧热△H=_______________kJ/mol。
(2)在恒温恒压装置中进行工业合成氨反应,下列说法正确的是 。
| A.气体体积不再变化,则已平衡 |
| B.气体密度不再变化,尚未平衡 |
| C.平衡后,往装置中通入一定量Ar,压强不变,平衡不移动 |
| D.平衡后,压缩装置,生成更多NH3 |
(3)在恒温恒容装置中进行合成氨反应,各组分浓度-时间图像如下。
① 表示N2浓度变化的曲线是 。
② 前25 min 内,用H2浓度变化表示的化学反应速率是 。
③ 在25 min末刚好平衡,则平衡常数K = 。
(4)在第25 min 末,保持其它条件不变,升高温度,在第35 min末再次平衡。平衡移动过程中H2浓度变化了1.5 mol·L-1,在图中画出第25 min ~ 40 min NH3浓度变化曲线。
(5)已知常温下,NH4+ 的水解常数为1.0×10-9,则0.1mol/L NH4Cl溶液pH= 。(忽略NH4+水解对NH4+浓度的影响)
计算题(共16分,写出计算过程)
1). 在标准状况下,224mL某气体的质量为0.40 g。试计算这种气体的摩尔质量。
2). 0.5L1 mol/L的CaCl2溶液,与多少L的0.5 mol/L AlCl3的Cl-的物质的量相等?
3). 若需要2.0 mol/LCuSO4溶液100 mL,配制此溶液应称取CuSO4·5H2O的质量是多少? (已知:CuSO4·5H2O的摩尔质量为250g/mol,CuSO4·5H2O ==CuSO4 + 5H2O)
4).在Cu + 2H2SO4(浓) △CuSO4 + SO2↑ + 2H2O中
①氧化剂是,氧化产物
②还原剂和氧化剂的物质的量之比是;还原性强弱比较:Cu SO2(填>或<)。
③若反应中消耗2mol Cu,则反应中转移mol电子。
(1)质量分数为36.5%密度为1.20 g·cm-3的浓盐酸,计算该盐酸的 物质量浓度。
物质量浓度。


 (2)取上述盐酸50.0ml,稀释成100 mL溶液,加入15.0g CaCO3充分产生的气体体积在标准状况下是多少?
(2)取上述盐酸50.0ml,稀释成100 mL溶液,加入15.0g CaCO3充分产生的气体体积在标准状况下是多少?

 (3)将上述产生的气体全部通入500mL浓度为0.400mol/L的NaOH溶液中完全反应,所得溶液中的溶质是什么?求其物质的量浓度。
(3)将上述产生的气体全部通入500mL浓度为0.400mol/L的NaOH溶液中完全反应,所得溶液中的溶质是什么?求其物质的量浓度。
以酚酞作为指示剂,用0.2000mol/L的NaOH标准液滴定20.0ml未知浓度的HCl溶液。当溶液有无色变为红色时,共滴入NaOH 10.00ml,求待测盐酸的浓度。
硫有多种含氧酸,亚硫酸(
)、硫酸(
)、焦硫酸(
)、硫代硫酸(
)等等,其中硫酸最为重要,在工业上有广泛的应用。在实验室,浓硫酸是常用的干燥剂。
完成下列计算:
(1)焦硫酸(
)溶于水,其中的
都转化为硫酸。若将445
焦硫酸溶于水配成4.00
硫酸,该硫酸的物质的量浓度为mol/L。
(2)若以浓硫酸吸水后生成的
计算,250
质量分数为98%的硫酸能吸收多少g水?
(3)硫铁矿是工业上制硫酸的主要原料。硫铁矿氧化焙烧的化学反应如下:
若48
完全反应耗用氧气2934.4
(标准状况),计算反应产物中
与
物质的量之比。
(4)用硫化氢制取硫酸,既能充分利用资源又能保护环境,是一种很有发展前途的制备硫酸的方法。
硫化氢体积分数为0.84的混合气体(
、
、
)在空气中完全燃烧,若空气过量77%,计算产物气体中
体积分数(水是气体)。(已知空气组成:
体积分数0.79、
体积分数0.21)
碱式碳酸铝镁
常用作塑料阻燃剂。
(1)碱式碳酸铝镁具有阻燃作用,是由于其受热分解需吸收大量热量和
(2) 中 、 、 、 的代数关系式为
(3)为确定碱式碳酸铝镁的组成,进行如下实验:
①准确称取3.390
样品与足量稀盐酸充分反应,生成
0.560
(已换算成标准状况下)。
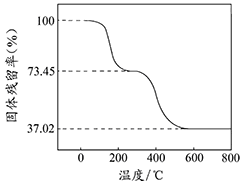
②另取一定量样品在空气中加热,样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如右图所示(样品在270
C时已完全失去结晶水,600
以上残留固体为金属氧化物的混合物)。
根据以上实验数据计算碱式碳酸铝镁样品中的
:
(写出计算过程)。