碘酸钾(KIO3)晶体是我国规定的食盐加碘剂。它通常是以碘为原料与过量KOH溶液通过下列反应制得:3I2+6KOH=5KI+KIO3+3H2O,再将KI和KIO3的混合溶液电解,将其中的I―转化为IO3―,装置如图。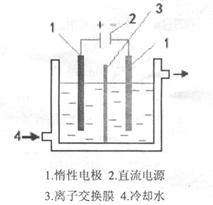
(1)在反应3I2+6KOH=5KI+KIO3+3H2O中,氧化剂和还原剂的物质的量之比为 。
(2)电解前,将KI和KIO3混合溶液加入阳极区;将氢氧化钾溶液加入阴极区。电解槽用水冷却。电解时,阳极上的电极反应 ;阴极上得到的气体产物为 ;
(3)某同学查资料获知:KIO3在酸性介质中与碘化物作用生成单质碘,该反应的离子反应方程式为 ,为确定电解是否完成,需检验阳极区电解液中是否含有I―,该同学选用淀粉溶液和稀硫酸进行实验,其它仪器及用品自选,请完成其方案:
| 实验操作 |
现象及结论 |
| |
|
(4)电解完毕,从电解液中得到KIO3晶体的过程为: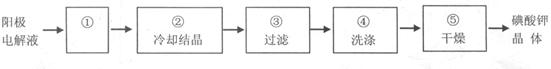
步骤①的操作名称 ,步骤④中洗涤晶体的目的 。
试回答下列中和热测定的有关问题
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、环形玻璃搅拌棒、0.50mol·L-1盐酸、0.55mol·L-1NaOH溶液,尚缺少的实验用品是________________。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒(填“能”或“不能”)__________,其原因是______________________________________________。
(3)实验时所用盐酸及NaOH溶液的体积均为50mL,各溶液密度为1g/cm3,生成溶液的比热容c=4.18J/(g·℃),实验起始温度为20℃,终止温度为23.2℃。试计算该反应的中和热ΔH=_________。
(12分)某化学兴趣小组用下图所示装置进行探究实验,以验证产物 中有乙烯生成且乙烯具有不饱和性。当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色。
(1)写出该实验中生成乙烯使溴水褪色的化学方程式:_______________________。
(2)甲同学认为:考虑到该混合液反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是()
a.乙烯与溴水易发生取代反应
b.使溴水褪色的反应,未必是加成反应
c.使溴水褪色的物质,未必是乙烯
(3)乙同学经过细致观察后认为试管中液体分层,油状液体在下层的现象可证明反应中有乙烯生成,请你写出下层该物质与NaOH水溶液加热反应的化学方程式 __________________。
(4)丙同学对上述实验装置进行了改进,在Ⅰ和Ⅱ之间增加如图装置,以除去乙烯中的杂质气体,则A中的试剂应为B中的试剂应为________,气体经过B无现象即可证明是较为纯净的乙烯。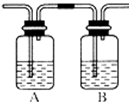
(5)若证明乙烯和溴发生的是加成反应,而不是取代反应,可将产生的气体经净化后通入溴的四氯化碳溶液,再接入如图装置,向 D中加入_________溶液,若无淡黄色沉淀产生,则能证明。
某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.
探究乙酸、碳酸和苯酚的酸性强弱关系该校学生设计了下图的实验装置(夹持仪器已略去).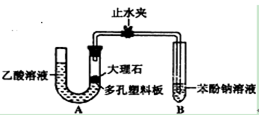
(1)某生检查装置A的气密性时,先关闭止水夹,从左管向U型管内加水,至左管液面高于右管液面,静置一段时间后,若U型管两侧液面差不发生变化,则气密性良好.你认为该生的操作正确与否?_________ (填“正确”或“错误”)大理石与乙酸溶液反应的化学方程式为 _________
(2)装置A中反应产生的气体通入苯酚钠溶液中,实验现象为 _________ 反应的离子方程式为 _________
(3)有学生认为(2)中的实验现象不足以证明碳酸的酸性比苯酚强,理由是乙酸有挥发性,挥发出的乙酸也可以和苯酚钠溶液反应,生成苯酚.改进该装置的方法是 _________ 证明乙酸为弱酸
(4)现有pH=3的乙酸溶液、蒸馏水、石蕊试液及pH试纸,选用适当的仪器和用品,用最简便的实验方法证明乙酸为弱酸 _______ __
(5)在相同温度下,测定相同物质的量浓度
a.NaHCO3溶液 b.Na2CO3溶液 c.CH3COONa溶液 d. ﹣ONa溶液
﹣ONa溶液
的pH,其pH由大到小排列的顺序为 _________ (填溶液编号)
在生产生活中,金属腐蚀所带来的损失非常严重,所以防止金属腐蚀已经成为科学研究和技术领域的重大问题.兴趣小组的同学在实验室对金属腐蚀进行了探究.
(1)分别在三个洁净干燥的试管中各加一个洁净无锈的铁钉,再在其中两个试管中加入经煮沸迅速冷却的蒸馏水,其它操作请仔细观察图1:_________ 号试管中的铁钉最容易生锈.由此可见,铁制品生锈需要的条件是_________ .
(2)如图2所示,铁处于A、B、C三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号):_________ .
(3)据报道,全世界每年因为金属腐蚀造成的直接经济损失约达7000亿美元,我国因金属腐蚀造成的损失占国民生产总值(GNP)的4%.
①钢铁在发生电化学腐蚀时,负极反应为:_________ .
②请写出用稀硫酸除去铁锈的化学反应方程式为:_________ .
③请根据不同的原理,提出防止钢铁腐蚀的两条合理措施:_________ 、_________ .
为了比较卤素单质的氧化性强弱,可在实验室先制取Cl2,并将Cl2依次通入NaBr溶液和淀粉KI溶液中。有如下图所示的仪器(橡胶塞均为双孔)及药品,试回答:
(1)若所制气体从左向右流向时,上述仪器接口的连接顺序为H接____、___接___、___接___。
(2)装置3的作用是_______________,反应的离子方程式为________________________。
(3)装置1中产生的现象是_________________,反应的化学方程式为_______________。
(4)通过本实验可得到的结论是____________________________________。