实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化: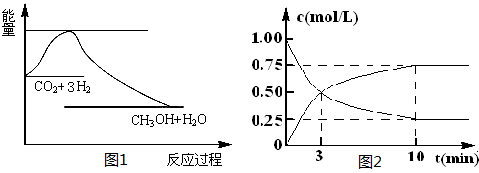
(1)关于该反应的下列说法中,正确的是 (填字母)。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH) = ;H2的转化率w(H2) = 。
②该反应的平衡常数表达式K= 。
③下列措施中能使化学平衡向正反应方向移动的是 (填字母)。
A.升高温度
B.将CH3OH(g)及时液化抽出
C.选择高效催化剂
D.再充入l molCO2和4 molH2
(3)25℃,1.01×105Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式: 。
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极应加入和通入的物质有 ;其正极的电极反应式是: 。
(6分)A、B、C都是短周期元素,原子序数的相对大小为A<B<C,A、B同主族,B、C可形成共价化合物BC4,试回答:
(1)写出BC4的电子式。
(2)这三种元素对应氢化物的稳定性由强到弱的顺序是。(用氢化物的化学式表示)
(3)BC4不稳定,遇水易生成B的含氧酸及C的氢化物,近代海战中常采用喷BC4和液氨的方法形成烟幕,有关化学反应的方程式为。
(8分)(1)下列叙述中正确的是………………………………()
| A.用酒精萃取溴水中的溴时,可用分液漏斗待静置分层后分液。 | |
B.向酒精灯中添加酒精时,需在熄灭后,用小漏斗向酒精灯中添加满酒精。 |
C.稀释浓硫酸时,应将浓H2SO4沿烧杯壁慢慢加入水中,并不断搅拌。 |
| D.称取NaOH固体时,不能直接放在托盘上,而应用称量纸称量,并慢慢称取以使称量更准确。 |
E.见光易分解的药品如浓HNO3、AgNO3等应保存在棕色瓶中,并置于阴暗处。
F.过滤过程中洗涤沉淀时,应向沉淀上加水并不断搅拌,使水自然流下,并重复2—3次。
(2)右图是滴定管的一部分(每小格为0.1mL),图中液面的读数为mL;如果右图是量筒的一部分(每小格为0.1mL),则图中液面的读数为mL。
某纯碱样品中只含有NaHCO3杂质,兴趣小组为了测定该样品中Na2CO3的纯度,设计了以下几种实验方案:
方案I:取一定量的样品配成溶液,滴加2滴酚酞,用c mol/LHCL溶液滴定至无色,用去HCl溶液的体积为V1mL;再滴加2滴甲基橙,继续用c mol/LHCl溶液滴定至橙色,又用去HCl溶液的体积为V2mL。用c、V1、V2计算出Na2CO3的纯度。
方案Ⅱ:称取m1 g样品溶于水,滴加过量BaCl2溶液,过滤,将所得BaCO3沉淀经洗涤、干燥后称得其质量为m2 g,用m l、m2计算出Na2CO3的纯度。
方案Ⅲ:称取m3g样品与足量稀H2SO4溶液反应,用排饱和碳酸氢钠溶液的方法测得生成的CO2的体积为V3 L(已折换成标准状况),用m3、V3计算出Na2CO3的纯度。
方案Ⅳ:称取m4g样品与足量稀H2SO4溶液反应,将生成的气体用碱石灰吸收,称量,
测得生成的CO2的质量为m5 g,用m4、m5计算出Na2CO3的纯度。
回答下列问题;
(1) 方案I中依次发生的反应的离子方程式是:、
(2) 方案Ⅱ中,怎样检验加入的BaCl2溶液已过量,请简述操作方法:
(3) 方案Ⅲ和Ⅳ中都有CO2生成,不需要干燥就可测定CO2体积或质量的是方案.(填序号);若生成的CO2部分残留在反应容器中,会使实验结果产生误差的是方案(填序号),此误差会使测得的Na2CO3的纯度(填“偏大”或“偏小”)。
(4) 不用任何化学试剂(除样品外),请你再设计一个实验方案,测定该纯碱样品中Na2CO3的纯度
短周期主族元素A、B、C、D、E的原子序数依次增大,它们的原子核外电子层数之和为10;B的化合物种类繁多,数目庞大。C、D是空气中含量最多的两种元素;D、E两单质在不同条件下反应可以生成两种不同的离子化合物。
(1)写出E的单质与A、D两元素形成的常见化合物反应的离子方程式:______________。
(2)由B、D两种元素组成的化合物,该化合物是大气温室效应的主要气体,写出该化合物的电子式 。
(3)由A、C、D三元素所形成的常见盐溶液呈_________性(填“酸”、“中”、“碱”),其原因 用离子方程式表示为:_______________________________。
用离子方程式表示为:_______________________________。
(4)X、Y是由C、D两元素组成的两种化合物,且
C、D在X、Y中的价态相同,某温度下相互转化时
的量变关系如图所示:
①X的化学式是_________________。
②图中a、b、c、d四点中,表示反应处于平
衡状态的是____________________________
③反应进行到 时刻,改变的条件可能是
时刻,改变的条件可能是
_____________________________________。
乙酸苯甲酯是某类化妆品生产的常用添加剂(香料),工业上可以石油产品乙烯、X为主要原料合成,其流程图如下。请完成填空:
(1) 已知A、B的相对分子质量相差16,反应①的化学方程式为________
(2)X的结构简式为 ____________,④的反应类型是
(3)乙酸苯甲酯有多种同分异构体,其中属于酯类、且为一取代苯结构的有种(不包括乙酸苯甲酯本身),任写其中一种的结构简式。
(4)除图示方法外,请你另设计一种最佳方案由 制得A(用类似以上流程图表示)。
制得A(用类似以上流程图表示)。
(5)若将反应③、④的条件做如下变动,将先后得到 、
、 而得不到
而得不到 、
、 :
:
已知 与
与 的分子式相同,且
的分子式相同,且 可与
可与 溶液发生显色反应,写出符合条件的由X→
溶液发生显色反应,写出符合条件的由X→ (
( 的一硝基代物有2种)的反应方程式________________。
的一硝基代物有2种)的反应方程式________________。