现有某铁碳合金(铁和碳两种单质的混合物),某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置(夹持仪器已省略)和实验方案进行实验探究。
I 测定铁的质量分数:
(1)检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在E装置后面连上一根导管,然后__________________________________,则证明装置的气密性良好。
(2)称量E的质量,并将a g铁碳合金样品放入装置A中,再加入足量的浓硫酸,待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g。铁碳合金中铁的质量分数为__________________________(写表达式)。
(3)装置C的作用______________________________________________。
(4)甲同学认为,依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,原因是___________________________________________________________。
(5)乙同学按照甲同学认为改进实验,改进方法是______________但测得合金中铁的质量分数却偏高。你认为其中可能的原因是_________________。
Ⅱ 探究浓硫酸的某些性质:
(6)往A中滴加足量的浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:________________________________________________。
(7)A中铁与浓硫酸发生反应的化学方程式是_______________________。
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
FeCl3溶液含有淀粉的碘水 NaOH溶液
A B C
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在中,再加水稀释,这样操作的目的是。
(2)装置C的作用是。
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、、自然干燥,在这一系列操作中没有用到的仪器有(填序号)。
| A.蒸发皿 |
| B.石棉网 |
| C.漏斗 |
| D.烧杯 |
E.玻璃棒
F.坩埚
(4)根据以上现象,该小组同学认为SO2与 FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式;
②请设计实验方案检验有Fe2+生成;
③该小组同学向C烧杯反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42—。该做法(填“合理”或“不合理”),理由是。
(5)能表明I-的还原性弱于SO2的现象是。
某兴趣小组设计如下图实验装置进行实验。
Ⅰ、探究大气污染物SO2的性质
(1)为了实现绿色环保的目标,能否用上图A2代替A1装置(填“能”或“否”)。
(2)B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂
为,C中反应的离子方程式为,D中反应的化学方程式
为。
Ⅱ、探究铜片与浓H2SO4反应的产物
实验结束,发现在铜片表面附着黑色固体。查阅资料得知:此黑色固体可
能含有CuO、CuS、Cu2S。常温下CuS和Cu2S都不溶于稀盐酸,在空气中煅烧都转化为Cu2O和SO2。该小组同学收集一定量黑色固体,按如下实验方案探究其成分:
(3)步骤Ⅱ 中检验滤渣洗涤干净的实验方法是____________________________。
(4)黑色固体的成分是________________。
Ⅲ、尾气处理
用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。
(5)氨水吸收过量SO2的反应的离子方程为。
固体硝酸盐加热易分解且产物较复杂。某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:
甲:Mg(NO3)2、NO2、O2乙:MgO、NO2、O2丙:Mg3N2、O2丁:MgO、NO2、N2
(1)实验前,小组成员经讨论认定猜想丁不成立,理由是____________。
查阅资料得知:2NO2+2NaOH=NaNO3+NaNO2+H2O
针对甲、乙、丙猜想,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
(2)实验过程
①取器连接后,放人固体试剂之前,关闭k,微热硬质玻璃管(A),观察到E 中有气泡连续放出,表明________
② 称取Mg(NO3)2固体3 . 79 g置于A中,加热前通人N2以驱尽装置内的空气,其目的是________;关闭K,用酒精灯加热时,正确操作是先________然后固定在管中固体部位下加热。
③ 观察到A 中有红棕色气体出现,C、D 中未见明显变化。
④ 待样品完全分解,A 装置冷却至室温、称量,测得剩余固体的质量为1.0g
⑤ 取少量剩余固体于试管中,加人适量水,未见明显现象。
(3)实验结果分析讨论
① 根据实验现象和剩余固体的质量经分析可初步确认猜想_______是正确的。
② 根据D 中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中将发生氧化还原反应:_____________________(填写化学方程式),溶液颜色会退去;小组讨论认定分解产物中有O2存在,未检侧到的原因是_____________________。
③ 小组讨论后达成的共识是上述实验设计仍不完善,需改进装里进一步研究。
亚硝酸钠(NaNO2)暴露于空气中会与氧气反应生成硝酸钠,在纤维纺织品的染色和漂白、照相、生产橡胶、制药等领域有广泛应用,也常用于鱼类、肉类等食品的染色和防腐。但因其有毒,所以在食品行业用量有严格限制。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。
已知:①NO+NO2+2OH—==2NO2—+H2O②气体液化的温度:NO2:21℃,NO:-152℃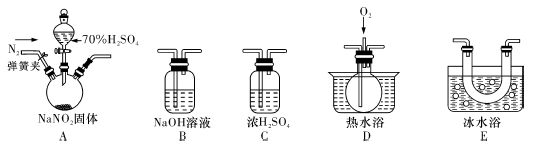
(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接):A、C、、、。
(2)反应前应打开弹簧夹,先通人一段时间氮气,排除装置中的空气,目的是。
(3)在关闭弹簧夹,打开分液漏斗活塞,滴人70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是。
②装置E的作用是。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为。如果没有装置C,对实验结论造成的影响是。
(5)通过上述实骏探究过程,可得出装置A中反应的化学方程式是。
某研究性学习小组在研究由Fe2+制备Fe(OH)2的过程中,设计了如下实验方案:
【实验设计】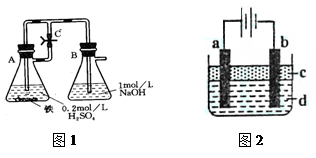
方法一:按照图1进行实验,容器A中的反应开始时,弹簧夹C处于打开状态,一段时间后,关闭弹簧夹C,容器A中的反应仍在进行。最终在_______容器中观察到白色沉淀,该实验中涉及到的化学方程式有:。
方法二:按图2进行实验,最终在两极间的溶液中首先观察到白色沉淀。请从所提供的试剂或电极材料中选择正确的序号填在横线上:①纯水②NaCl溶液③NaOH溶液④四氯化碳⑤CuCl2溶液⑥乙醇⑦Fe棒⑧植物油⑨碳棒
a为___________,b为___________,c为___________,d为___________。(填序号)
【探究思考】
实验表明上述实验中出现白色的沉淀会逐渐转变为灰绿色或绿色,那么如何解释出现灰绿色或绿色的现象呢?
(1)甲同学查阅资料后,得到Fe(OH)2如下信息:
| 资料名称 |
物理性质描述 |
化学性质描述 |
| 《化学辞典》,顾翼东编,1989年版P637 |
白色无定形粉末或白色至淡绿色六方晶体 |
与空气接触易被氧化,将细粉喷于空气中,则立即燃烧出火花 |
| 《大学普通化学(下册)》傅鹰著P637 |
白色沉淀 |
此沉淀易被氧化成微绿色Fe3(OH)8 |
| 《普通化学教程》(下册)P788 |
白色 |
能强烈吸收O2,迅速变成棕色 Fe(OH)3。这时作为氧化的中间产物为土绿色,其中含有Fe2+、Fe3+。 |
阅读该资料后,你对上述实验中出现灰绿色或绿色的现象的解释是:__________;资料中提及的微绿色Fe3(OH)8,用氧化物的形式表示可写成__________________。
(2)乙同学依据配色原理:白色和棕色不可能调配成绿色或灰绿色的常识,认为绿色可能是形成Fe(OH)2·nH2O所致。用热水浴的方式加热“方法一”中生成的绿色沉淀,观察到沉淀由绿变白的趋势。加热时,“方法一”中弹簧夹C应处于___________(填“打开”或“关闭”)状态,容器A中的反应须处于___________(填“停止”或“发生”)状态。写出该实验中支持乙同学观点的化学方程式_______________。