高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) △H= -28.5 kJ·(mol-1
2Fe(s)+3CO2(g) △H= -28.5 kJ·(mol-1
(1)已知:C(石墨)+CO2(g) 2CO(g) △H=" +" 172.5 kJ·mol-1
2CO(g) △H=" +" 172.5 kJ·mol-1
则反应:Fe2O3(S) +3C(石墨) 2Fe(s)+3CO(g) △H= kJ·mol-1
2Fe(s)+3CO(g) △H= kJ·mol-1
(2)冶炼铁反应 Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) △H=-28.5 kJ·mol-1的平衡常数表达式K= ,温度降低后,K值 .(填“增大”、“不变”或“减小”)。
2Fe(s)+3CO2(g) △H=-28.5 kJ·mol-1的平衡常数表达式K= ,温度降低后,K值 .(填“增大”、“不变”或“减小”)。
(3)在ToC时,该反应的平衡常数K=27,在1L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
| |
Fe2 O3 |
CO |
Fe |
CO2 |
| 甲容器 |
1.0 mol |
1.0 mol |
1.0 mol |
1.0 mol |
| 乙容器 |
1.0 mol |
2.0 mol |
1.0 mol |
1.0 mol |
①甲容器中CO的平衡转化率为
②下列说法正确的是 (填字母)。
a.乙容器中CO的平衡转化率小于甲容器
b.甲、乙容器中,CO2的平衡浓度之比为2:3
c.当容器内气体压强保持不变时,标志反应达到平衡状态
d.当容器中气体密度保持不变时,标志反应达到平衡状态
(4)钢铁工业是国家工业的基础,请回答钢铁腐蚀与防护过程中的有关问题。
①下列哪个装置可防止铁棒被腐蚀 (填编号)。
②在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图:A电极对应的金属是 (写元素名称),B电极的电极反应式是 。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因 。
活性氧化锌是一种多功能性的新型无机材料,其颗粒大小约在1-100纳米。某化工冶金研究所采用湿化学法(NPP-法)制备纳米级活性氧化锌,可用各种含锌物料为原料,采用酸浸出锌,经过多次净化除去原料中的杂质,然后沉淀获得碱式碳酸锌,最后焙解获得活性氧化锌,化学工艺流程如下: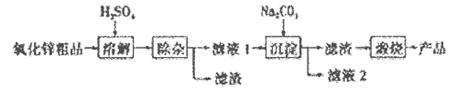
(1)通过__________(填操作名称)可以检验流程中滤液2中含有Na+。
(2)若上述流程图中Na2CO3溶液的pH=12,下列说法正确的是___________。
A该溶液中
B.该溶液中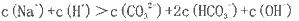
C.该溶液中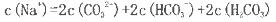
D.若将该溶液稀释至100倍,则pH=10。
(3)“溶解”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+等杂质。取0.5L该溶液先加入___________(填“Na2CO3”或“H2SO4”)调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4转化为MnO2。经检测溶液中Fe2+的浓度为0 009 mol/L,则该溶液中至少应加入_______molKMnO4 .
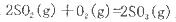 反应过程的能量变化如图所示。已知l mol SO2(g)氧化为1 molSO3 (g)的
反应过程的能量变化如图所示。已知l mol SO2(g)氧化为1 molSO3 (g)的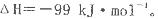 。请回答下问题;
。请回答下问题;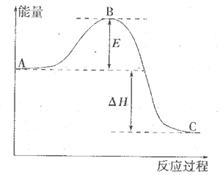
(1)E表示___________________;E的大小对该反应的反应热__________(填“有”或“无”)影响。
(2)该反应通常用V2O5作催化剂,加V2O5会使图中△H___________(填“变大”、“变小”或“不变”),理由是________。
(3)已知单质硫的燃烧热为296 kJ·mol ,计算由S(s)生成2mol SO3(g)的△H =________________。
,计算由S(s)生成2mol SO3(g)的△H =________________。
(4)在一定条件下向容积为2L的容器中通入4molSO2和3molO2,充分反应达平衡后,SO3的体积分数为1/3。若在相同的条件下向容积为2L的容器中通入amolSO2和,bmolSO3,和cmol,反应向逆反应方向进行且达到平衡时SO3的体积分数也为1/3。则c的取值范围为___________。
【物质结构与性质】
根据元素周期表中第四周期元素的相关知识,回答下列问题:
(1)第四周期元素的基态原子的电子排布中4s轨道上只有1个电子的元素有_______种;
写出Cu+的核外电子排布式_________。
(2)按电子排布,可将周期表里的元素划分成五个区域,第四周期元素中属于s区的元素有___________种,属于d区的元素有________种。
(3)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为________;CaO的焰色反应为砖红色,许多金属或它们的化合物都可以发生焰色反应,其原因是________。
(4)由叠氮化钾(KN3)热分解可得纯 ,下列有关说法正确的是________(填选项字母)。
,下列有关说法正确的是________(填选项字母)。
| A.NaN3与KN3结构类似,前者晶格能较小 |
B.晶体钾的晶胞结构如右图所示,每个晶胞中分摊2个钾原子 |
| C.氮的第一电离能大于氧 |
| D.氮气常温下很稳定,是因为氮的电负性小 |
(5)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂。O2在其催化作用下,可将CN-氧化成CNO-。CN-的电子式为________,CNO-的中心原子的杂化方式为____________。
(6)在CrCl3溶液中,一定条件下存在组成为 (n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
将含0.0015mol 的溶液,与R-H完全交换后,中和生成的需浓度为
的溶液,与R-H完全交换后,中和生成的需浓度为
0.1200 mol/LNaOH溶液25.00 mL,则该配离子的化学式为____________。
【有机化学基础】
白酒产品中的塑化剂主要源于塑料接酒桶、塑料输酒管、成品酒塑料内盖等。DBP是塑化剂的一种,可由下列路线合成:
已知以下信息:
(1)A的结构简式是________,D的结构简式是________,D→E的反应类型是________。
(2)D和H2l:l反应生成E,则E官能团名称为________,DBP的分子式为________。
(3)由B和E以物质的量比1:2合成DBP的化学方程式为____________。
(4)写出同时符合下列条件的B的所有同分异构体的结构简式____________。
①能和NaHCO3溶液反应生成CO2③能使FeCl3溶液发生显色反应
②能发生银镜反应④苯环上含碳基团处于对位
(5)写出B与碳酸氢钠溶液反应的化学方程式________。
写出C生成D的反应的化学方程式________。
某科研小组设计出利用工业废酸(l0%)来堆浸某废弃的氧化铜锌矿的方案,实现废物综合利用,如下图所示。
已知:各离子开始沉淀及完全沉淀时的pH如下表所示。
请回答下列问题:
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS
不溶,则相同温度下:Ksp(CuS)______Ksp(ZnS)(选填“>”“<”或“=”)。
(2)物质A可使用下列物质中的。
| A.KMnO4 | B.O2 | C.H2O2 | D.Cl2 |
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在________范围之间。
(4)物质B可直接用作氮肥,则B的化学式是________。
(5)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境下将其氧化得到一种高效的多功能水处理剂——K2FeO4,写出该反应的离子方程式__________。