南海某小岛上,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示水的硬度为280(属于硬水),主要含钙离子、镁离子、氯离子和硫酸根离子。请回答下列问题。
(1)该泉水属于 硬水(填写“暂时”或“永久”)。
(2)若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂加入时的先后次序是 ,原因是 。
(3)目前常用阴、阳离子交换树脂来进行硬水的软化,如水中的Ca2+、Mg2+可与交换树脂中的 交换。当阴离子交换树脂失效后可放入 溶液中再生。
(4)岛上还可以用海水淡化来获得淡水。右边是海水利用电渗析法获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请分析下列问题: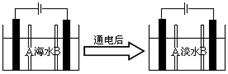
①阳离子交换膜是指 (填A或B);
②写出通电后阳极区的电极反应式: 。
对含氮物质的研究和利用有着极为重要的意义。
(1)N2、O2和H2相互之间可以发生化合反应,已知反应的热化学方程式如下:
N2(g)+O2(g)=2NO(g) H=+180.5kJ·mol-1;
H=+180.5kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) H =-483.6 kJ·mol-1;
H =-483.6 kJ·mol-1;
N2(g)+3H2(g)=2NH3(g) H =-92.4 kJ·mol-1。
H =-92.4 kJ·mol-1。
H2O(g) = H2O(l) ΔH =-44.0 kJ/mol
则氨的催化氧化反应生成液体水的热化学方程式为 。
(2)汽车尾气净化的一个反应原理为:2NO(g)+2CO(g) N2(g)+2CO2(g)
N2(g)+2CO2(g) H<0。
H<0。
一定温度下,将2.8mol NO、2.4mol CO通入固定容积为2L的密闭容器中,反应过程中部分物质的物质的量变化如图所示。
①增大压强,NO的平衡转化率 (填“增大”、“减小”、“不变”),0~20min平均反应速率v(NO)为 。25min时,若保持反应温度不变,再向容器中充入NO、CO2各1.2 mol,则化学平衡将 移动(填“向左”、“向右”或“不”)。
②若只改变某一反应条件X,反应由原平衡I达到新平衡II,变量Y的变化趋势如下图所示。下列说法正确的是 (填字母代号)。
(3)某化学小组拟设计以N2和H2为电极反应物,以HCl—NH4Cl为电解质溶液制成燃料电池,则该电池的正极反应式为 。假设电解质溶液的体积不变,下列说法正确的是 (填字母代号)。
a.放电过程中,需要向燃料电池中补充H+
b.溶液中的NH4Cl浓度增大, 所以Cl-离子浓度也增大
c.每转移6.02 1023个电子,则有标准状况下11.2L电极反应物被氧化
1023个电子,则有标准状况下11.2L电极反应物被氧化
d.为保持放电效果,电池使用一段时间需更换电解质溶液
【有机化学基础】弹性涤纶是一种新型聚酯纤维,具有优异性能,能作为工程塑料、纺织纤维和地毯等材料而得到广泛应用。其合成路线可设计为:
其中A、B、C均为链状化合物,A能发生银镜反应,C中不含甲基,1mol C可与足量钠反应生成22.4 L H2(标准状况)。请回答下列问题:
(1)A的结构简式为 ,B中所含官能团的名称为 。
(2)由物质C与D反应生成弹性涤纶的化学方程式为 。
(3)由物质B到C的化学反应类型为 。
(4)写出C与足量钠反应的化学方程式 。
【物质结构与性质】Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
| 元素 |
Mn |
Fe |
|
| 电离能kJ/mol |
I1 |
717 |
759 |
| I2 |
1509 |
1561 |
|
| I3 |
3248 |
2957 |
|
回答下列问题:
(1)Mn元素核外电子的电子排布式为 ,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。其原因是 。
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①Fe原子或离子易形成配合物的原因是 ,
与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 。
②络离子[Fe(CN)6]4-的配体CN-中C原子的杂化轨道类型是 ,HCN的分子构型为 ,写出一种与 CN-互为等电子体的单质分子的电子式 。
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁的晶体构成微粒为 。
(4)金属铁晶体在不同的温度下有两种堆积方式,如图所示。体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为 。
(17分)合成氨技术的发明使工业化人工固氮成为现实。
(1)已知N2(g)+3H2(g) 2NH3(g)
2NH3(g) H=-92.2kJ·mol-1。在一定条件下反应时,当电子转移3mol时,放出的热量为 。
H=-92.2kJ·mol-1。在一定条件下反应时,当电子转移3mol时,放出的热量为 。
(2)合成氨混合体系在平衡状态时NH3的百分含量与温度的关系如下图所示。由图可知:
①温度T1、T2时的平衡常数分别为K1、K2,则K1 K2(填“>”或“<”)。若在恒温、恒压条件下,向平衡体系中通入氦气,氮气的平衡转化率 (填“增大”、“减小”或“不变”)。
②T2温度时,在1L的密闭容器中加入2.1mol N2、l.5molH2,经10min达到平衡,则v(NH3)= 。达到平衡后,如果再向该容器内通入N2、H2、NH3各0.4mol,则V正 V逆(填“>”或“<” 或“=”)。
(3)工业上用CO2和NH3反应生成尿素:CO2(g)+2NH3(g) H2O(1)+CO(NH2)2(1) △H,
H2O(1)+CO(NH2)2(1) △H,
在一定压强下测得如下数据:
①该反应破坏旧化学键吸收的能量 形成新化学键放出的能量,表中数据a d,b f(均选填“>”、“=”或“<”)。
②从尿素合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理 。
【有机化学基础】迷迭香酸(F)的结构简式为: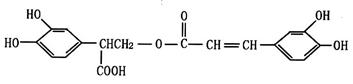
它是存在于许多植物中的一种多酚,具有抗氧化、延缓衰老、减肥降脂等功效,以A为原料合成F的路线如下(已知苯环上的羟基很难直接与羧酸发生酯化反应):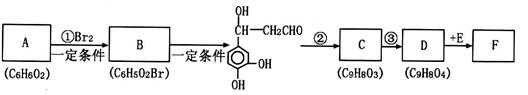
根据题意回答下列问题:
(1)B的结构简式为 ;
反应②的化学方程式为 。
(2)反应③反应类型为 ,选用的试剂为 。
(3)D与E生成F的反应类型为 ,1molF分别与足量的溴水、氢气、NaOH溶液反应,最多可消耗Br2 mol,H2 mol, NaOH mol。
(4)E在一定条件下发生缩聚反应的化学方程式是 。