2014年3月22日是第二十二届“世界水日”,保护水资源,从我做起!
(1)ClO2和Cl2(还原产物都为Cl-)是生活中常用的消毒剂。当消耗等物质的量的两种物质时,ClO2的消毒效率是Cl2的_______倍。
(2)炼金废水中含有络离子[Au(CN)2]+,与弱电解质碳酸的电离方式相似,[Au(CN)2]+也存在着两步电离,其电离出CN-有毒,CN-与H+结合生成毒性更强的HCN。 [Au(CN)2]+的一级电离方程式: ;在碱性条件下NaClO将废水中的CN-氧化成CO和N2,其反应的离子方程式为: 。
(3)某无色废水中可能含有Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-离子中的几种,为分析其成分,分别取废水样品100mL,进行了三组实验,其操作和有关现象如下图所示:
请根据上图回答下列问题:
①实验中需配制1.0mol/L的NaOH溶液100mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为________________。
②实验③中沉淀量由A→B过程中所发生反应的离子方程式为_________________ ___。
③试确定NO3-是否存在?_________________(填“存在”、“不存在”或“不确定”),若存在,试计算 _________________(若不存在,此问不必作答)。
_________________(若不存在,此问不必作答)。
(4)聚合硫酸铁又称聚铁,其化学式为[Fe2(OH)n(SO4)(3―0.5n)]m(n>2,m≤10),它是一种高效的无机高分子混凝剂、净水剂。 某中学化学兴趣小组查资料获取测定聚铁中含铁量的方法:把聚铁溶于过量酸中,先用过量SnCl2将Fe3+还原成 Fe2+:Sn2+ + 2Fe3+ + 6Cl-= 2Fe2+ + SnCl62-,再加入HgCl2溶液除去过量的SnCl2:Sn2+ + 2Hg2+ + 8Cl- = Hg2Cl2↓+ SnCl62-,然后用标准的K2Cr2O7溶液(先加入几滴试亚铁灵指示剂)滴定溶液中的Fe2+。若称取聚铁质量为10.00g配成100.0 mL溶液,取出20.00 mL,经上述方法处理后,再用0.1000 mol·L—1K2Cr2O7标准溶液滴定,达到终点时,消耗标准溶液12.80 mL,则聚铁中铁元素的质量分数为 %。(保留小数点后一位)
高炉炼铁中发生的基本反应之一如下:
FeO(s)+ CO(g)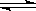 Fe(s)+ CO2(g) ΔH>0。已知1100℃时,K=0.26
Fe(s)+ CO2(g) ΔH>0。已知1100℃时,K=0.26
(1)写出该反应的平衡常数表达式:_______________________________。
(2)温度升高,化学平衡移动后达到新的平衡,平衡常数K值_________(填“增大”、“减小”或“不变”)。
(3)1100℃时,测得高炉中c(CO2)=0.025mol·L-1,c(CO)=0.1mol·L-1,在这种情况下,该反应__________(填“已”或“没有” )处于化学平衡状态,此时化学反应速率V正 ______ V逆。(填“大于”、“小于”或“等于” )。
可用于分离或提纯物质的方法有:①过滤 ②蒸馏 ③加热分液(填序号)
(1)除去石灰水中悬浮的CaCO3颗粒
(2)除去NaCl晶体中混有的碘单质
(3)分离石油中各不同沸点范围的成分
(4)分离水和苯的混合物
(5)分离CCl4(沸点76.75℃)和甲苯(沸点110.6℃)____________。
2001年11月20日,解放日报报道:南太平洋岛国“图瓦卢被迫全国移民 “到新西兰。该国前总理佩鲁曾声称“图瓦卢是温室效应的第一个受害者”。目前该国正面临生存环境的严重恶化的局面。该国岛屿近20年来已被海水侵蚀的千疮百孔,岛上的淡水日益减少;海水的大量侵入使土壤盐碱化,粮食和蔬菜无法正常生长。图瓦卢陆地最高处仅海拔4.5m,由于海平面日渐升高,据估计这些岛屿将于50年内被海水淹没,请根据以上材料分析:
(1)图瓦卢是由多个珊瑚礁形成的岛国,由于大气中二氧化碳气体含量的剧增,大量珊瑚礁(主要成分是碳酸钙)被海水侵蚀,其原因是(用方程式表示)
(2)为了控制温室效应,各国科学家提出了不少方法和设想。有人根据液态二氧化碳气体的密度大于海水密度的事实,设想将二氧化碳液化后送入伸海海底。以减少二氧化碳气体的浓度。为使二氧化碳液化,可采用的方法是()
A、减压、升温 B、增压、升温 C、减压、降温 D、增压、降温
(3)科学家致力于二氧化碳的“组合转化”技术研究,把过多的二氧化碳转化为有利于人类的物质。如将二氧化碳和氢气1:4的的物质的量比混合,通入反应器。在适当的条件下反应可获得一种重要的新能源。请完成以下化学方程式
 CO2+ 4H2() +2H2O
CO2+ 4H2() +2H2O
若将二氧化碳和氢气1:3的的物质的量比混合,在一定条件下生成某重要的化工原料和水,该化工原料可能是 ()
A、烷烃 B、烯烃 C、炔烃 D、芳香烃
煤是一种常用的燃料,由于煤燃烧产生的废气含有SO2、NO2和NO等多种有害气体和烟尘会对环境造成污染,因此需要对煤进行加工后再燃烧,或将废气净化后再排放
(1)将煤直接进行燃烧,造成环境污染的主要方面之一是形成硝酸型酸雨
①写出有关物质转化为硝酸的化学方程式
②以下是对硝酸型酸雨的若干项评价,其中正确的是
a:杀死水中的浮游生物,减少鱼类食物的来源,破坏水生生态系统
b:对电线,铁轨,桥梁,房屋等均会造成严重损害
c:导致臭氧层空洞
d:硝酸与土壤中的矿物质发生作用转化为硝酸盐,向植物提供氮肥。
(2)对煤用石灰石进行脱硫处理,过程中发生的方程式为:
(3)脱硫后,在废气中含有的不良气体是,它对环境的负面影响是。
(4)检验脱硫后废气中是否含有SO2的简单方法是。
某石墨回收厂,为将回收的石墨棒处理成疏松状的碳粉,采用浓硫酸蒸煮废石墨棒的落后生产工艺,这种落后工艺所造成的恶劣后果是排入水体的废酸液导致严重环境污染。试完成下列问题:
(1)浓硫酸蒸煮石墨发生的化学方程式____________________________________ 这种方法除废酸污染水体外,还将_________(填化学式)污染大气。
(2) 该厂每天向附近溪水中排放400吨废酸液,现某环保小组测得该溪水中污染指数如下:
| PH值 |
水中悬浮物(mg/l) |
氟化物(mg/l) |
化学需氧量(CODmg/l) |
| 1.8 |
7143 |
3100 |
2670 |
以上数据表明氟化物超过国家规定标准310倍,COD超过国家规定标准260倍。
为净化这条溪水,除责令该厂停产整顿外,主管部门决定,建在这条溪水上游的某水库开闸放水以稀释污染物。请计算溪水的流量应为每秒多少立方米时才能使该溪水中氟化物、COD指标达到国家规定的排放标准,此时溪水的PH值为多少?(原小溪中水忽略不计)