(l)火法炼锌是将闪锌矿(主要成分是ZnS)通过浮选焙烧使它转化为氧化锌,再把氧化锌和焦 炭混合,在鼓风炉中加热到1100~1300℃,使锌蒸馏出来。
①写出火法炼锌的主要反应:
焙烧反应: 。
鼓风炉中可能发生的反应: (任写一个)
②从保护环境和充分利用原料角度看如何处理和利用产生的烟气?
(2)工业上冶炼铝就是电解氧化铝
①冶炼铝的电解槽中的阴极和阳极材料均用石油炼制和煤的干馏产品 (填物质名称)
②氧化铝的熔点很高,在铝的冶炼中要加入冰晶石(Na3AlF),其作用是____ 。
③工业上冶炼铝时用的原料是Al2O3,而不是AlCl3,其原因是 。
(3)工业上“联合制碱法”中主要反应的化学方程式是 。其中的CO2来源于 。
(4)磁酸钙是制玻璃的原料之一,工业上制玻璃是在玻璃熔炉中进行,其中反应之一为: ,若在上述条件下,把l000ag CaCO3和60ag SiO2混合,则生成的CO2在标准状况下的体积为 (用含a的代数式表示)。
,若在上述条件下,把l000ag CaCO3和60ag SiO2混合,则生成的CO2在标准状况下的体积为 (用含a的代数式表示)。
(1)2 molO3与3 molO2的质量之比_______,分子数之比_______,同温同压下的密度之比_____,含氧原子数之比_______,体积之比_______.
(2)O3与Cl2具有相似的性质,均可用于自来水的消毒.已知二者在消毒时均被还原为最低价态,则相同状况下10 L O3与________L Cl2的消毒能力相当.
(3)气体化合物A分子式可表示为OxFy,已知同温同压下10 mL A受热分解生成15 mL O2和10 mL F2,则A的化学式为________,推断的依据为_______________________
化学键的键能是原子间形成1 mol化学键(或其逆过程)时释放(或吸收)的能量。以下是部分共价键键能的数据:
H—S:364 kJ·mol-1,S—S:266 kJ·mol-1,S===O:522 kJ·mol-1,
H—O:464 kJ·mol-1。
(1)试根据这些数据计算下面这个反应的反应热:
2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=-Q kJ·mol-1,反应产物中的S实为S8,实际分子是8元环状分子( 提示:由8molS形成8mol S—S可推知平均1molS含有的S—S,然后计算),则Q=_________。
提示:由8molS形成8mol S—S可推知平均1molS含有的S—S,然后计算),则Q=_________。
(2)标准状况下,将a L H2S与b L SO2混合进行上述反应,当a>2b时,反应放热____________kJ·mol-1;当a<2b时,反应放热____________kJ·mol-1。
(3)又已知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1请写出(1)中反应若生成气态水时的热化学方程式。
反应 A+3B = 2C+3D在四种不同情况下的反应速率分别为:
①v
| A.=0.015 mol (L·s) -1② v | B.=0.06 mol (L·s) -1 ③v |
C.=2.4 mol (L·min ) -1④ v | D.=0.045mol (L·s) -1 |
该反应进行的快慢顺序为
已知下列三个热化学方程式
①H2(g)+O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
②C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
③C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131 kJ·mol-1
写出表示碳燃烧生成CO和CO燃烧生成CO2的燃烧热的热化学方程式。
_________________________________________;
_________________________________________。
已知涤纶树脂的结构简式为: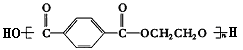 ,它是________和________(填单体的结构简式)通过____________反应而制的,反应的化学方程式为:______________________________________________。
,它是________和________(填单体的结构简式)通过____________反应而制的,反应的化学方程式为:______________________________________________。