利用化学原理对工厂排放的废水、废渣等进行有效检测与合理处理。
(一)染料工业排放的废水中含有大量有毒的NO2-,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO2-的离子方程式为________。
(二)某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):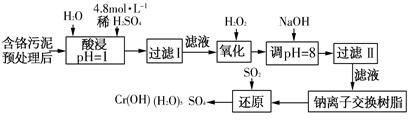
常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 |
Fe3+ |
Fe2+ |
Mg2+ |
Al3+ |
Cu2+ |
Cr3+ |
| 开始沉淀 时的pH |
1.9 |
7.0 |
— |
— |
4.7 |
— |
| 沉淀完全 时的pH |
3.2 |
9.0 |
11.1 |
8 |
6.7 |
9(>9溶解) |
(1)酸浸时,为了提高浸取率可采取的措施是________(至少写一条)。
(2)调pH=8是为了除去________(填Fe3+、Al3+、Ca2+、Mg2+)。
(3)钠离子交换树脂的原理为Mn++nNaR→MRn+nNa+,被交换的杂质离子是________(填Fe3+、Al3+、Ca2+、Mg2+)。
(4)试配平氧化还原反应方程式:□Na2Cr2O7+□SO2+□H2O = □Cr(OH)(H2O)5SO4+□Na2SO4;每生成1mol Cr(OH)(H2O)5SO4消耗SO2的物质的量为________。
(三)印刷电路铜板腐蚀剂常用FeCl3。腐蚀铜板后的混合浊液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol·L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:①________;②________;③过滤。(提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu)。
Ⅰ、取少量Fe2O3粉末,向其中加入适量盐酸使其充分溶解。
(1)上述反应的化学方程式为 反应后得到的溶液呈 色。
(2)取少量上述溶液,置于试管中,滴入NaOH溶液,可观察到有 色沉淀生成,发生反应的化学方程式为:此反应属于 (填基本反应类型)反应。
Ⅱ、(3)在甲烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴入几滴 FeCl3溶液,继续煮沸直至溶液呈 色,停止加热,即可以制得Fe(OH)3胶体。制备Fe(OH)3胶体的化学方程式:
(4)另取乙烧杯,加入20mL蒸馏水,向烧杯中加入1mL FeCl3溶液,震荡均匀后,将乙烧杯与甲烧杯一起置于暗处,分别用激光笔照射烧杯中的液体,可以看到 烧杯中的液体产生 ,这个实验可以用来区别 。
(5)取甲烧杯中的少量Fe(OH)3胶体于试管中,向试管中逐滴滴加稀盐酸,
现象: ,原因: ,
如果有反应,方程式为:
某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行实验,实验内容如下:
根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是_____________________________________;
(2)写出有关离子方程式:步骤①中生成A__________________;步骤②生成沉淀I__________________。
(3)假设测定A、F、I均为0.01 mol,10 mL X溶液中n(H+)=0.04 mol,而沉淀C物质的量0.07 mol,能说明该溶液不能确定的阴离子存在的理由是___________________。
综合利用CO2对环境保护及能开发意义重大。
(1)Li2O、Na2O、MgO均能吸收CO2。如果寻找吸收CO2的其他物质,下列建议合理的是______________。
a. 可在碱性氧化物中寻找
b. 可在ⅠA、ⅡA族元素形成的氧化物中寻找
c. 可在具有强氧化性的物质中寻找
(2)Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是_________________________。
(3)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:
已知:
反应A的热化学方程式是______________________________。
(4)高温电解技术能高效实现(3)中反应A,工作原理示意图如下:
① 电极b发生 (填“氧化”或“还原”)反应。
② CO2在电极a放电的反应式是___________________________。
(Ⅰ)地壳中含量第一金属元素构成的单质A与化合物B(相对分子质量为232)发生置换反应,产物为黑色固体C和另一单质D,单质D与水蒸气在高温下可得到B。则
(1)写出构成金属单质A的元素在周期表中的位置为 。
(2)写出D与水蒸气反应的化学方程式 。
(Ⅱ)某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下:
(3)物质X的化学式为___________。“碱溶”时反应的离子方程式为_____________。
(4)为加快“酸浸”时的速率,可采取的措施有 、 等。(填两种即可)
(5)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4。为了获得更多产品Al(OH)3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作的实验方案是____________________________。
二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式___ _____。
(2)已知:Se + 2H2SO4(浓) → 2SO2↑ + SeO2 + 2H2O
2SO2 + SeO2 + 2H2O → Se + 2SO42-+ 4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是_____________________。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
① SeO2 + KI + HNO3 → Se + I2 + KNO3 + H2O ② I2 + 2Na2S2O3 → Na2S4O6 + 2NaI
配平方程式①,标出电子转移的方向和数目________________________________。
(4)实验中,准确称量SeO2样品0.1500 g,消耗了0.2000 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为_____________。