以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备二氧化氯气体,再用水吸收获得二氧化氯溶液。在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2气体的吸收率。具体情况如图6所示。请回答下列问题
(1)据图可知,反应时需要控制的适宜温度是 ℃,达到此要求采取的适宜措施是 。
(2)已知:黄铁矿中的硫元素在酸性条件下被ClO3-氧化成SO42-,写出制备二氧化氯的离子方程式: 。
(3)某校化学学习小组拟以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标。若取NaClO3样品质量6.0g,通过反应和吸收可得400 mL ClO2溶液,取出20 mL,加入37.00 mL 0.500mol·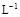 (NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500 mol·
(NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500 mol·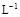 K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下:
K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下:
4H++ClO2+5Fe2+= +5Fe3+ +2H2O
+5Fe3+ +2H2O
14H+ + +6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O
+6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O
试计算ClO2的“产率”。(写出计算过程)
将等物质的量的A.B混合于2L的密闭容器中,发生下列反应3A(g)+B(g)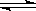 xC(g)+2D(g),经反应5min后,测知D的浓度为0.5mol/L,A.B的物质的量浓度之比为3∶5,C的平均反应速率是0.1mol/(L·min),试计算:
xC(g)+2D(g),经反应5min后,测知D的浓度为0.5mol/L,A.B的物质的量浓度之比为3∶5,C的平均反应速率是0.1mol/(L·min),试计算:
(1)x的值?
(2)5min内B的平均反应速率?
(3)5min时A的物质的量浓度?
高温时空气中的N2和O2会反应生成NO而污染大气:N2(g)+O2(g)==NO(g)。式通过计算说明在1200℃的条件下,此反应能否正向自发进行?估算自发进行的最低温度是多少?(已知:△H="180.50" kJ·mol-1 ,△S=247.7J·mol-1 ·K-1 )
10分)电子工业中清洗硅片上的SiO2(s)的反应是
SiO2(s)+4HF(g) ==SiF4(g)+2H2O(g) △H(298.15K)=-94.0kJ·mol-1 △S(298.15K)=-75.8J·mol-1 ·K-1 设△H和△S不随温度而变,试求此反应自发进行的温度条件。
某有机化合物A含碳77.8%,氢为7.40%,其余为氧,A的相对分子质量为甲烷的6.75倍。求:
(1)该有机物的分子式。
(2)红外光谱测定,A分子结构中含有苯环和羟基,能与烧碱反应,且在常温下A可与浓溴水反应,1molA最多可与2molBr2作用,据此确定该有机物的结构简式。
向8克二价金属的氧化物固体中加入稀硫酸,使其恰好完全溶解,已知所消耗的硫酸体积为100毫升,在所得溶液插入铂电极进行电解,通电一定时间后,在一个电极上收集到224毫升(标准状况)氧气,在另一个电极上得到1.28克该金属。
(1)根据计算确定金属氧化物的名称。
(2)计算通电后硫酸溶液的物质量浓度(溶液体积按100毫升计算)。