“神七”登天谱写了我国航天事业的新篇章。火箭升空需要高能的燃料,通常用肼(N2H4)作为燃料,N2O4做氧化剂。
(1)已知:N2(g) + 2O2(g) =2NO2(g) △H=+67.7 kJ·mol-1
N2H4(g) + O2(g) =N2(g) + 2H2O(g) △H=-534.0 kJ·mol-1
2NO2(g) N2O4(g) △H=-52.7 kJ·mol-1
N2O4(g) △H=-52.7 kJ·mol-1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式: 。
(2)工业上可用次氯酸钠与过量的氨反应制备肼,该反应的化学方程式为: 。
(3)一定条件下,在2L密闭容器中起始投入2 mol NH3和4 mol O2发生反应:
4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH<0
4NO(g)+6H2O(g) ΔH<0
测得平衡时数据如下:
| 平衡时物质的量(mol) |
n(NO) |
n(H2O) |
| 温度T1 |
1.6 |
2.4 |
| 温度T2 |
1.2 |
1.8 |
①在温度T1下,若经过10min反应达到平衡,则10min内反应的平均速率
v(NH3)= 。
②温度T1和T2的大小关系是T1 T2(填“>”、 “<”或“=”)。
(4)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为: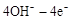 =O2↑+2H2O,则阴极反应为 。有人提出,可以设计反应2CO=2C+O2(△H>0)来消除CO的污染。请你判断上述反应是否能自发进行并说明理由 。
=O2↑+2H2O,则阴极反应为 。有人提出,可以设计反应2CO=2C+O2(△H>0)来消除CO的污染。请你判断上述反应是否能自发进行并说明理由 。
(5)下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液。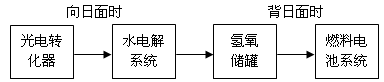
如果某段时间内氢氧储罐中共收集到33.6L气体(已折算成标准状况),则该段时间内水电解系统中转移电子的物质的量为 mol。
某有机物的相对分子质量为102,若该有机物含碳、氢、氧三种元素,其中含氢的质量分数为9.8%,分子中氢原子个数为氧原子的5倍。该有机物的分子式是 ;若该有机物能与金属钠发生反应,则取5.1 g 该有机物,和足量Na反应,最多能产生标态下气体 L。
【化学--选修3物质结构与性质】
铜、铁都是日常生活中常见的金属,它们的单质及其化合物在科学研究和工农业生产中具有广泛用途。
请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:
①Cu2+的价电子排布图 ; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为_______________________(填元素符号)。
② 的空间构型为_____________,
的空间构型为_____________, 离子中心原子的杂化方式为 。
离子中心原子的杂化方式为 。
(2)请写出向Cu(NH3)4SO4水溶液中通入SO2时发生反应的离子方程式: 。
(3)某学生向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体。 ①下列说法正确的是
a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成3种不同的氢键
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键
d.Cu(NH3)4SO4组成元素中电负性最大的是氮元素
②请解释加入乙醇后析出晶体的原因 .
(4)Cu晶体的堆积方式如图所示,
设Cu原子半径为r, 晶体中Cu原子的配位数为_______,晶体的空间利用率为 (  ,列式并计算结果)。
,列式并计算结果)。
((1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO-)(填“ >” 或“=”或“<” )。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,
溶液中c(Na+) c(CH3COO-)
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 ,醋酸体积 氢氧化钠溶液体积。
(4)将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+) 氢氧化钠溶液中c(OH-),m与n的大小关系是m n。
下图为以惰性电极进行电解:
(1)写出A、B、C、D各电极上的电极方程式:
A________________________________
B________________________________
C________________________________
D________________________________
(2)在A、B、C、D各电极上析出生成物的物质的量比为____________________________。
(在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g)。其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g)。其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 。
a. 容器中压强不变 b. 混合气体中c(CO)不变
c. v正(H2)=v逆(H2O) d. c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O)。试判断此时的温度为_____________