金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)写出Ti基态原子的电子排布 。
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。则电负性C B(选填“>”“<”),第一电离能N>O,原因是 。
(3)月球岩石·玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。SO2—4的空间构型为 ,其中硫原子采用 杂化,氧原子的价电子排布图为 ,任意写出一种SO2—4的等电子体 。
(4)将TiOSO4的稀溶液加热水解后,经进一步反应,可得到钛的某种氧化物。该氧化物的晶胞结构图如图所示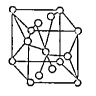 。则该氧化物的化学式 (图中钛原子用“O”表示。氧原子用“O”表示)
。则该氧化物的化学式 (图中钛原子用“O”表示。氧原子用“O”表示)
“西气东输”是西部开发的重点工程,这里的气是指天然气,其主要成分是甲烷。工业上将碳与水在高温下反应制得水煤气,水煤气的主要成分是CO和H2,两者的体积比约为1∶1。已知1 mol CO气体完全燃烧生成CO2气体放出283 kJ热量;1 mol氢气完全燃烧生成液态水放出286 kJ热量;1 mol CH4气体完全燃烧生成CO2气体和液态水放出890 kJ热量。
(1)写出氢气完全燃烧生成液态水的热化学反应方程式:_____________________,
若1 mol CH4气体完全燃烧生成CO2气体和水蒸气,放出的热量_______890 kJ(填“>”、“=”或“<”)。
(2)忽略水煤气中其他成分,相同状况下若得到相等的热量,所需水煤气与甲烷的体积比约为_______;燃烧生成的CO2的质量比约为_______。
(3)以上数据和计算说明,以天然气代替水煤气作民用燃料,突出的优点是___________。
现有A、B、C、D、E五种物质,它们均含同一种元素,有以下转化关系:
已知A、B、C、X在常温下为气体,Z为液体,Y为紫红色金属,A与D的浓溶液相遇会产生白烟E。
请回答下面问题:
(1)写出A、Z的电子式AZ _____
(2)写出下列反应的方程式:
① A与D溶液反应的离子方程式
② A转化为B的化学方程式:
③已知A与C在一定条件下能反应,且生成两种没有污染的物质。请写出该反应的化学方程式。
A、B、C、D、E五种短周期主族元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素可形成两种固体,其中一种是淡黄色的固体X,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A元素在元素周期表中的位置,D的阴离子结构示意图,E的最高价氧化物对应的水化物是_______(填化学式)。
(2)B的氢化物沸点比D的氢化物沸点高,原因是。
(3)物质X的电子式,它与AB2反应的化学方程式。
(4)实验室制取E单质的离子方程式为____________________________。
用化学用语填空:
(1)原子核内有8个质子和10个中子,则表示该核素的符号为
(2)二氧化碳的结构式______________ 。
(3)用石墨电极电解饱和食盐水的阳极的电极反应式。
(4)钢铁发生吸氧腐蚀时正极的电极反应式。
(6分)利用Cu + 2FeCl3 = CuCl2 + 2FeCl2反应,设计一个原电池,写出电极反应式。