纯碱(Na2CO3)在生产生活中具有广泛的用途。以下是实验室模拟制碱原理制取Na2CO3的流程图
已知:向饱和食盐水中通入NH3,CO2后发生和反应为NaCl+NH3+CO2+H2O NaHCO3↓+NH4Cl,请回答以下问题:
NaHCO3↓+NH4Cl,请回答以下问题:
(1)粗盐中含有的杂质离子有Ca2+,Mg2+,SO42-等。
精制除杂的步骤顺序a→_______→________→________→b(填字母编号)。
a.粗盐溶解,滤去沉渣.b.加入盐酸调pH;c.加入Ba(OH)2溶液;d.加入Na2CO3溶液;e.过滤
向饱和食盐水中先通入NH3,后通人CO2,理由是_____________________。
(2)灼烧固体A制Na2CO3在_____填字母序号)中进行。
a.坩埚 b.蒸发皿 c.烧杯 d.锥形瓶
证明滤液A中含有NH4+的方法是__________________________________________________________。
对滤液A进行重结晶能够获得NH4HCO3,向pH=13含Na+,K+的溶液中加入少量NH4HCO3。使pH降低,反应的离子方程式____________________________________。
(3)下图装置中常用于实验室制备CO2的是_____(填字母编号);用b示意的装置制备NH3,分液漏斗中盛放的试剂______(填试剂名称),烧瓶内可加入的固体试剂__________(填试剂名称)。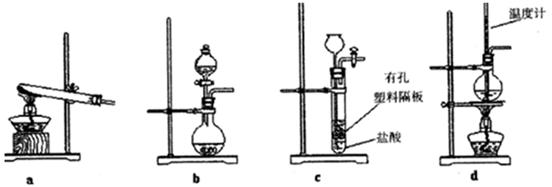
(4)一种天然碱晶体成分是aNa2CO3·bNa2CO3·cH2O,某同学利用下列提供的试剂,设计了如下简单合理测定Na2CO3的质量分数的实骏方案。(仪器自选)请把实验方案填全:供选择的试剂:1.0mol/LH2SO4溶液、1.0mol/L BaCl2溶液、稀氨水、碱石灰、Ca(OH)2溶液、蒸馏水
①称取m1g一定量天然碱晶体样品,溶于适量蒸馏水中。
②_________________________________________________________________。
③_________________________________________________________________。
④计算天然碱晶体中含Na2CO3的质量分数。
某混合金属粉末,除Mg外,还含有Al、Zn中的一种或两种,含量都在10%以上.某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在.
所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3·H2O.
该小组探究过程如下:
●查阅资料:
| ①镁、铝、锌都是银白色的金属; ②锌(Zn)可以与NaOH溶液反应生成H2; ③Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3·H2O; ④Zn2+易形成络合物如[Zn(NH3)4]2+,该络合物遇强酸分解生成Zn2+、NH4+. |
● 提出假设:
(1)假设①:该混合金属粉末中除镁外还含有________元素
假设②:该混合金属粉末中除镁外还含有________元素
假设③:该混合金属粉末中除镁外还含有铝、锌元素
●实验探究:
甲同学基于假设③设计实验方案如下:
乙同学同样基于假设3设计另一实验方案如下:
(2)试剂M是____________,沉淀B是_____________.
(2)试剂M是____________,沉淀B是_____________.
(3)丙同学认为乙同学的方案比甲同学的好,理由是_______________________.
(4)丁同学研究了甲、乙两同学的方案后,在其中一种方案的基础上用最简便方法测定了Wg样品中金属镁(Mg)的质量,他的方法是____________________________.
(5)操作Ⅰ的主要过程是:在滤液中逐滴加入_______________,直至生成的沉淀刚好溶解,再加入足量的____________________.
某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。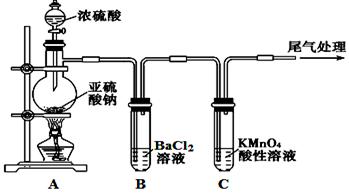
已知:Na2SO3+H2SO4(浓)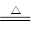 Na2SO4+SO2↑+H2O
Na2SO4+SO2↑+H2O
请回答下列问题:
(1)装置A中盛放浓硫酸的仪器名称是。
(2)实验过程中,C中的现象是,说明SO2具有性。
(3)实验过程中,观察到装置B中出现了明显的白色沉淀。为探究该白色沉淀的成分,该小组同学进行了如下实验: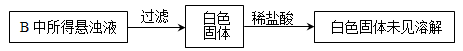
根据实验事实判断该白色沉淀的成分是(填化学式),产生该白色沉淀的原因可能是(填字母编号)。
a.BaSO3既不溶于水也不溶于酸
b.BaCl2溶液中可能溶解有氧气
c.BaCl2溶液中可能混有NaOH
d.由A制得的SO2气体中可能混有氧气
(4)写出B中产生白色沉淀的离子方程式为:____________________________
(5)如果将装置A中的浓H2SO4换作浓HNO3,对此实验是否有影响并明理由。
为探索工业废料的再利用,某化学兴趣小组设计了如下左图实验方案,用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。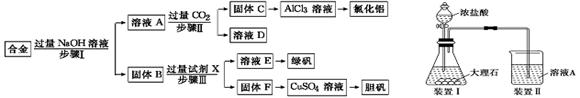
请回答:
(1)步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是,该操作中除用到烧杯和玻璃棒外,还必须用到的玻璃仪器有。
(2)试剂X是
(3)步骤Ⅱ中发生反应的离子方程式是:_______________________________________
(4)进行步骤Ⅱ时,该小组用如上右图所示装置及试剂将制得的CO2气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,为了避免固体C减少,改进的措施是在装置Ⅰ、Ⅱ之间增加一个________________________________________。
(5)溶液D中各离子的浓度由大到小的顺序为:__________________________________
(6)工业上由X和F制得CuSO4,还必须使用的最恰当的试剂可以是_____或_________。
| A.浓H2SO4 | B.Fe2O3 | C.HNO3 | D.O2 E.H2O2 |
(7)从溶液E中获得绿矾晶体的实验操作依次为(填操作名称)、冷却结晶、过滤洗涤。
某研究性学习小组的一个课题是“NO2能否支持木条的燃烧?”由于实验室中没有现成的NO2气体,该小组的同学设计了两个方案(忽略N2O4的存在,图中铁架台等夹持仪器均已略去):
Ⅰ.实验装置如下图1所示
图1图2
(1)浓硝酸受热分解的化学方程式是 。
(2)实验开始后木条上的火星逐渐熄灭,有的同学得出“NO2不能支持木条的燃烧”的结论。你认为这一结论是否正确?(填“正确”或“不正确),理由是。
Ⅱ.实验装置如上图2所示
(1)硝酸铜固体加热分解的产物有氧化铜、二氧化氮和氧气,该反应的化学方程式是。
(2)当集气瓶中充满红棕色气体时,木条复燃了,有的同学得出“NO2能支持木条的燃烧”的结论。你认为这一结论是否正确?(填“正确”或“不正确”),理由是。
Ⅲ.为了更直接说明“NO2能否支持木条的燃烧”这一问题,请你重新设计一个简单的实验方案,简述实验原理和主要操作。
海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
(1)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br‾,其目的为。
(2)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是。
(3)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,了如下装置简图:
请你参与分析讨论:
①图中仪器B的名称。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:。
④C中液体产生颜色为。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是。