(14分)用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液。称量时,样品可放在 (填编号字母)上称量
(A)小烧杯 (B)洁净纸片 (C)直接放在托盘上
(2)滴定时,用0.2000mol·L-1的盐酸来滴定待测溶液,不可选用 (填编号字母)作指示剂。
(A)甲基橙 (B)石蕊 (C)酚酞
(3)滴定过程中,眼睛应注视 ;在铁架台上垫一张白纸,其目的是 。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是 mol·L-1,烧碱样品的纯度是 。
| 滴定次数 |
待测溶液体积(mL) |
标准酸体积 |
|
| 滴定前的刻度(mL) |
滴定后的刻度(mL) |
||
| 第一次 |
10.00 |
0.40 |
20.50 |
| 第二次 |
10.00 |
4.10 |
24.00 |
(5)下列实验操作会对滴定结果产生的后果。(填“偏高”、“偏低”或“无影响”)
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果 。
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果 。
氯化铁是一种重要的化学试剂和化工原料,工业上以黄铁矿(主要成分为FeS2)为原料在制备硫酸的同时,利用其煅烧后炉渣的主要成分Fe2O3可制备氯化铁晶体(FeCl3·6H2O),其工艺流程如下(杂质不参与反应):
回答下列问题:
(1)高温煅烧时,黄铁矿要粉碎成细小的颗粒,其目的是 。
(2)黄铁矿高温煅烧时发生反应的化学方程式 。
(3)酸溶及后续过程中均需保持盐酸过量,其目的是 、 。
(4)系列操作包括:蒸发浓缩、 、 、洗涤等。蒸发与过滤时玻璃棒的作用分别是: 、 。
(5)取a g黄铁矿,按上述流程制得FeCl3·6H2O晶体,将该晶体溶于水,再将所得溶液蒸干、灼烧,得到b g固体产物(整个过程中的损耗忽略不计),黄铁矿的纯度为 (用含a、b的表达式表示)。
某小组用下图所示装置对Cl2与Na2S2O3的反应进行探究(气密性已检验)。
实验操作和现象:
| 操作 |
现象 |
| 打开分液漏斗活塞,滴加一定量浓盐酸,加热 |
i.A中有黄绿色气体生成,C中液面上方有白雾,溶液中开始出现少量浑浊; ii.一段时间后,C中产生大量黄色沉淀。 |
| 用湿润的淀粉碘化钾试纸检验C中白雾 |
淀粉碘化钾试纸变蓝 |
| C中浊液过滤后,取少量滤液用盐酸酸化,滴加氯化钡溶液 |
有白色沉淀生成 |
查阅资料:a.S2O32—有较强的还原性
b.酸性条件下S2O32—迅速分解为S和SO2
(1)A中发生反应的离子方程式是。
(2)B中饱和NaCl溶液的作用是。
(3)C中生成黄色沉淀的离子方程式是。
(4)为检验C中是否有SO2生成,需进行的操作是。
(5)C中滤液与氯化钡溶液反应生成白色沉淀,甲同学认为利用该现象可证明Na2S2O3被Cl2氧化,反应的离子方程式是。
(6)乙同学认为,C中滤液用硝酸酸化后滴加硝酸银溶液,若有白色沉淀,也能证明Na2S2O3被Cl2氧化,丙同学认为不能证明,理由是。
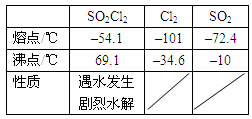
某学习小组依据反应:SO2(g)+ Cl2(g) SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如下图,有关信息如下表所示。
SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如下图,有关信息如下表所示。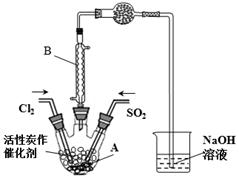
(1)若用浓盐酸与二氧化锰为原料制取Cl2,反应的化学方程式为___________。
(2)B仪器的作用是________________。
(3)为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择_____。
a.冰水浴 b.常温 c.加热至69.1℃
(4)如果通入的Cl2或SO2含有水蒸气,氯气和二氧化硫可能发生反应的化学方程式为_____________。
(5)实验时先通入干燥的Cl2将A装置中的空气赶走,再缓慢通入干燥的SO2,即发生反应。充分反应后,继续通入Cl2使装置中的SO2进入烧杯中被吸收。分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液W。
①经分析SO2Cl2与H2O反应属于非氧化还原反应,写出该反应的化学方程式___________。
②无色溶液W中的阴离子除含少量OH-外,还含有其它两种阴离子,检验溶液W中这两种阴离子方法是_______________________________________________。
③反应完成后,在W溶液、烧杯中分别滴加过量的BaCl2溶液,均出现白色沉淀,此沉淀不溶于稀盐酸,经过滤、洗涤、干燥,称量得到的固体质量分别为Xg、Yg。
(6)计算SO2+ Cl2 SO2Cl2反应中,SO2的转化率____________(用含X、Y的代数式表示)。
SO2Cl2反应中,SO2的转化率____________(用含X、Y的代数式表示)。
孔雀石主要成分是Cu2(OH)2CO3,还含少量FeCO3及Si的化合物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下: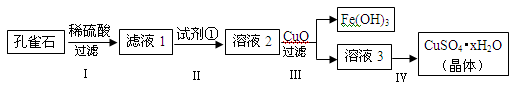
(1)步骤Ⅰ中涉及的反应用离子方程式表示为_____________________________。
(2)步骤Ⅱ中试剂①是__________(填代号)。
a.KMnO4b.H2O2c.Fe粉 d.KSCN
(3)步骤Ⅲ加入CuO的目的是___________________________。
(4)步骤Ⅳ获得硫酸铜晶体,需要经过_________、_________、过滤等操作。
(5)孔雀石与焦炭一起加热可以生成Cu及其它无毒物质,写出该反应的化学方程式_____________。
(6)测定硫酸铜晶体(CuSO4·xH2O)中结晶水的x值:称取2.4g硫酸铜晶体,加热至质量不再改变时,称量粉末的质量为1.6g。则计算得x=______(计算结果精确到0.1)。
氧化亚铜是大型水面舰艇防护涂层的重要原料。某小组通过查阅资料,进行如下研究。
I.Cu2O的制取
(1)葡萄糖还原法制Cu2O的化学方程式为。
(2)实验室用此方法制取并获得少量Cu2O固体,需要的玻璃仪器除试管、酒精灯、烧杯外,还需要。
II.检验样品中是否含有CuO
方案1:将制得的Cu2O样品溶于足量稀硫酸。
(3)甲同学认为若溶液变为蓝色,则说明样品中含有CuO杂质。乙同学认为此推论不合理,用化学用语解释原因。
(4)甲同学通过反思,认为将定性检验改为定量测定便能确定样品中是否含有CuO杂质,应测量的数据是。
方案2:丙同学认为采用如下装置(所加药品均足量)进行实验,通过测定c装置反应后固体的质量以及d装置反应前后增重的质量,可计算,从而确定样品中是否含有氧化铜。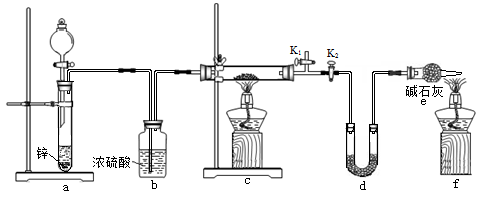
(5)装置a中所加的酸是(填化学式),装置e中碱石灰的作用是。
(6)点燃装置c中酒精灯之前需进行的操作是。
(7)熄灭酒精灯之后,仍需通一段时间H2至试管冷却,原因是。