某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的酸度(酸度单位:g/100ml),现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。下表是4种常见指示剂的变色范围:
| 指示剂 |
石蕊 |
甲基橙 |
甲基红 |
酚酞 |
| 变色范围 (PH) |
5.0-8.0 |
3.1-4.4 |
4.4-6.2 |
8.2-10.0 |
(1)该实验应选用 作指示剂,向锥形瓶中移取一定体积的白醋所用的仪器是 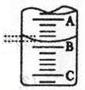
(2)上图表示50ml滴定管中液面的位置,若A与C刻度间相差1ml,A处的刻度为25,滴定管中液面读数为 ml。此时滴定管中液体的体积 。
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为Vml,NaOH标准液浓度为C mol/L,三次实验结果记录如下:
| 实验次数 |
第一次 |
第二次 |
第三次 |
| 消耗NaOH溶液体积/ml |
26.02 |
25.32 |
25.28 |
从上表可以看出,第一次实验中记录消耗NaOH溶液体积明显多于后两次,其原因可能是
| A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积 |
| B.滴定前滴定管尖嘴有气泡,滴定结束无气泡 |
| C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗 |
| D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗 |
E.滴定NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出计算该白醋中总酸度的表达式(可以不必化简): (酸度:每100ml溶液中含有溶质酸的质量,单位:g/100ml)
A~G为中学常见的化合物,它们之间有如图所示的转化关系(反应条件及部分产物已略去)。A是绿色固体,含H、C、O、Cu四种元素。常温下D为无色无味气体,B为黑色粉末,E能发生银镜反应。
请回答:
(1)D跟G反应的化学方程式为________________________;
(2)F中一定含有的官能团的名称为_______________________;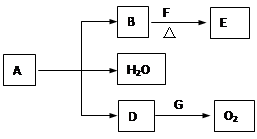
(3)某课外小组同学设计了下列实验装置,通过测定某些装置中试剂的质量变化,探究A中各元素的质量关系。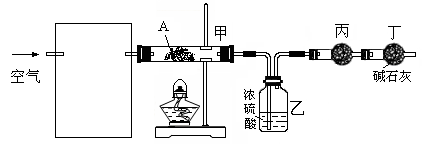
①为使数据准确,还需补充装置,请你在方框内绘出装置图并写出试剂名称;
②向装置中鼓入空气的目的是_________;丙装置中药品的名称为___________,实验时,该药品未见明显变化,证明______________;
③如何判断A已完全分解?
____________________________________________
____________________________________________。
④更精确的测定得出如下数据:A受热后完全分解,固体由8.0 g变为6.0 g,装置乙增重0.90 g。写出A的化学式(表示为碱式盐):____________________。
过氧化钙是一种温和的氧化剂,常温下为白色的固体,易溶于酸,难溶于水、乙醇等溶剂。某实验小组拟选用如下装置(部分固定装置略)制备过氧化钙。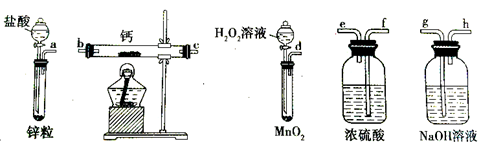
(1)请选择必要的装置,按气流方向连接顺序为 (填仪器接口的字母编号,装置可重复使用)。
(2)根据完整的实验装置进行实验,实验步骤如下:①检验装置的气密性后,装入药品;②打开分液漏斗活塞,通入一段时间气体,加热药品;③反应结束后, (填操作);④拆除装置,取出产物。
(3)利用反应Ca2++H2O2+2NH3+8H2O=CaO2 .8H2O↓+2NH4+,在碱性环境下制取CaO2的装置如下:
①装置A中发生反应的化学方程式为 。
②NH3在Ca2+和H2O2的反应历程中所起的作用是 。
③反应结束后,经 (填操作名称)、洗涤、低温烘干可获得CaO2 .8H2O。
检验CaO2 .8H2O是否洗涤干净的操作为 。
④已知CaO2 在350℃迅速分解生成CaO和O2。若所取产品质量是mg,加热至恒重时,
剩余固体ng,则产品中CaO2 的质量分数为 (用字母表示)。
(4)钙在空气中燃烧生成氮化钙(Ca3N2),同时可能生成过氧化钙。请利用下列试剂,设计试验检验钙的燃烧产物中是否含有过氧化钙 。(简要说明实验步骤、现象和结论)
限选试剂:酸化的FeCl2溶液、NaOH溶液、KSCN溶液、稀硝酸
阿司匹林(乙酰水杨酸, )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
主要试剂和产品的物理常数
| 名称 |
相对分子质量 |
熔点或沸点(℃) |
水 |
| 水杨酸 |
138 |
158(熔点) |
微溶 |
| 醋酸 |
102 |
139.4(沸点) |
反应 |
| 乙酸水杨酸 |
180 |
135(熔点) |
微溶 |
请根据以上信息回答下列问题:
(1)制备阿司匹林时,要使用干燥的仪器的原因是_____________________;
(2)写出制备阿司匹林的化学方程式_____________________;
(3)①合成阿斯匹林时,最合适的加热方法是____________;
②过滤所得粗产品要用少量冰水洗涤,则洗涤的具体操作是_____________________;
(4)提纯粗产物中加入饱和NaHCO3溶液至没有CO2产生为止,再过滤,则加饱和NaHCO3溶液的目的是_____________________;另一种改进的提纯方法,称为重结晶提纯法.方法如下:
(5)改进的提纯方法中加热同流的装置如下图所示,使用温度计的目的是_______________;冷凝水的流进方向是__________(填“b”或“c”)。
(6)检验产品中是否含有水杨酸的试剂是_______________;
(7)该学习小组在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(ρ=1.08g/cm3),最终称得产品m=2.2g,则所得乙酰水杨酸的产率为_______________;
氧化铁是一种红色的颜料,在工业上常以富含硫酸亚铁的废液为原料生产氧化铁,其主要流程如下:
已知步骤①中硫酸亚铁在不同温度下的溶解度和析出晶体的组成如下表所示.
| 温度/℃ |
0 |
10 |
30 |
50 |
56.7 |
60 |
64 |
70 |
80 |
90 |
||
| 溶解度/g |
14.0 |
17.0 |
25.0 |
33.0 |
35.2 |
35.3 |
35.6 |
33.0 |
30.5 |
27.0 |
||
| 析出晶体 |
FeSO4•7H2O |
FeSO4•4H2O |
FeSO4•H2O |
|||||||||
若从硫酸亚铁溶液中结晶出FeSO4•7H2O,控制的温度(t)为 ________________;
(1)步骤②需加一定量硫酸,其主要目的是________________;
(2)生产FeCO3浊液的离子方程式为________________;
(3)FeCO3浊液露置在空气中会出现红褐色的固体,该变化的化学方程式为___________;
(4)已知FeSO4•7H2O晶体在加热条件下发生反应,其中一种生成物会用于涂料中的着色剂。请写出FeSO4•7H2O分解的反应式___________________;利用如图装置可检验该反应的气体产物。
请填写下列空白:
①仪器的连接顺序为a 接_______、_____接_______、____接________、___接_____;
②装置C中的X为____________________。
实验室制备硝基苯的反应原理和实验装置如下:
存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯。
有关数据列如下表:
实验步骤如下:
取100mL烧杯,用20 mL浓硫酸与18 mL浓硝酸配制混和酸,将混合酸小心加入B中。把18 mL(15.84 g)苯加入A中。向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀。在50~60℃下发生反应,直至反应结束。
将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5%NaOH溶液和水洗涤。分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~210℃馏分,得到纯硝基苯18g。
回答下列问题:
(1)装置B的名称是___________。装置C的作用是_____________。
(2)配制混合酸时,能否将浓硝酸加入到浓硫酸中,说明理由:________________。
(3)为了使反应在50℃~60℃下进行,常用的方法是______________________。
(4)在洗涤操作中,第二次水洗的作用是__________________________。
(5)在蒸馏纯化过程中,因硝基苯的沸点高于140℃,应选用空气冷凝管,不选用直形冷凝管的原因是_______________________。
(6)本实验所得到的硝基苯产率是______________________。