某化学研究性学习小组设计制取氯气及探究其性质的方案,并按下图所示装置完成实验。(A中发生反应的化学方程式为:MnO2 + 4HCl(浓) ==== MnCl2 + Cl2↑ + 2H2O)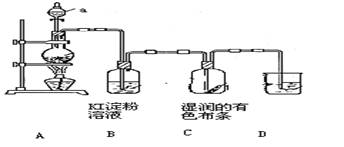
【实验探究】
(1)装置A中,仪器a的名称是 。
(2)装置B中无色溶液将变为 色,该反应的化学方程式是 。
(3)装置C中湿润的有色布条 (填“褪色”或“不褪色”),其原因是氯气与水反应生成了 (填化学式)
(4)为了吸收多余的氯气,防止造成空气污染,装置D中应盛放 ____溶液(填“NaOH”或“H2SO4”)
(5)用8.7gMnO2与足量浓盐酸反应,理论上可以生成标准状况下的Cl2 _______L。
【知识拓展】
(6)某同学查阅资料得知:高锰酸钾与浓盐酸在常温下也可以生成氯气(反应的化学方程式为:
2KMnO4 + 16HCl(浓) ="===" 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O),该反应的氧化剂是 (填“KMnO4”或“HCl”)
【知识应用】
(7)洪灾过后,饮用水的消毒杀菌是抑制大规模传染疾病爆发的重要措施之一。请你列举一例对饮用水进行消毒杀菌的合理方法:______________________________________________________________________
实验室制乙烯,常因温度过高生成少量SO2,有人设计了如下图所示实验,以验证上述混合气体中是否含有乙烯和SO2。
(1) 装置中X仪器的名称是:;碎瓷片的作用是:。
(2) 写出生成乙烯的反应方程式:。
(3)A、B、C、D装置中盛放的试剂是(从下列所给试剂中选出,填序号)
①品红溶液,②NaOH溶液,③ KMnO4酸性溶液。
A.B.C.D.
(4)能说明SO2气体存在的现象是。
(5)确证含有乙烯的现象是。
3,5二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:
甲醇、乙醚和3,5二甲氧基苯酚的部分物理性质见下表:
| 物质 |
沸点/℃ |
熔点/℃ |
密度(20 ℃) /g·cm-3 |
溶解性 |
| 甲醇 |
64.7 |
— |
0.791 5 |
易溶于水 |
| 乙醚 |
34.5 |
— |
0.713 8 |
微溶于水 |
| 3,5二甲氧基苯酚 |
— |
33~36 |
— |
易溶于甲醇、乙醚,微溶于水 |
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。①分离出甲醇的操作是________________。②萃取用到的分液漏斗使用前需________并洗净,分液时有机层在分液漏斗的________(填“上”或“下”)层。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3溶液洗涤的目的是________;用饱和食盐水洗涤的目的是________________________。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是________(填字母)。
a.蒸馏除去乙醚 b.重结晶
c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤。为了防止倒吸,减压过滤完成后应先________,再________。
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验,可选用试剂:KSCN溶液、K3[Fe(CN)6]溶液、氯水。
(1)请完成下表:
| 操作 |
现象 |
结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 |
存在Fe3+ |
|
| 取少量除尽Ag+后的溶液于试管中,加入________,振荡 |
存在Fe2+ |
【实验结论】 Fe的氧化产物为Fe2+和Fe3+。
Ⅱ.AgNO3的热稳定性
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束后,试管中残留固体为黑色。
(2)装置B的作用是________。
(3)经小组讨论并验证该无色气体为O2,其验证方法是________。
(4)【查阅资料】 Ag2O和粉末状的Ag均为黑色;Ag2O可溶于氨水。
【提出设想】试管中残留的黑色固体可能是:ⅰ.Ag;ⅱ.Ag2O;ⅲ.Ag和Ag2O。
【实验验证】该小组为验证上述设想,分别取少量黑色固体放入试管中,进行了如下实验。
| 实验编号 |
操作 |
现象 |
| a |
加入足量氨水,振荡 |
黑色固体不溶解 |
| b |
加入足量稀硝酸,振荡 |
黑色固体溶解,并有气体产生 |
【实验评价】根据上述实验,不能确定固体产物成分的实验是________(填实验编号)。
【实验结论】根据上述实验结果,该小组得出AgNO3固体热分解的产物有________。
氯气是一种重要的化工原料。某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。
(1)实验室用二氧化锰和浓盐酸加热制取氯气,发生装置中除圆底烧瓶和导管外还需用到的玻璃仪器有__________________。
(2)装置A中盛有的试剂是________,作用是___________________________________。
(3)若D中品红溶液褪色,则B装置中发生反应的离子方程式是________________。
(4)证明FeBr2与Cl2发生了氧化还原反应的实验方法是__________(填操作方法)。
某研究性学习小组用刚吸收过少量SO2的NaOH溶液吸收处理上述实验后的尾气。经分析吸收尾气一段时间后,吸收液(呈强碱性)中肯定存在Cl-、OH-、CO32—和SO42—,对于可能存在的其他阴离子,研究小组提出以下3种假设。假设1:只存在SO32—;假设2:只存在ClO-;假设3:既不存在SO32—,也不存在ClO-。
(5)学习小组判断同时存在SO32—和ClO-是不可能的理由是_____________________。
(6)现限选以下试剂,设计实验方案,进行实验,请写出实验步骤以及预期现象和结论。
a.3 mol·L-1 H2SO4 b.0.01 mol·L-1 KMnO4
c.1 mol·L-1 BaCl2溶液 d.淀粉碘化钾溶液
e.酚酞试液
步骤一:取少量吸收液于试管中,滴加3 mol·L-1 H2SO4至溶液呈中性,然后将所得溶液分装于A、B两试管中。
步骤二:向A试管中滴加少量__________(填序号),若溶液____________________(填现象),则假设1成立。
步骤三:向B试管中滴加少量__________(填序号),若溶液____________________(填现象),则假设2成立。
硫化氢(H2S)是一种具有臭鸡蛋气味的无色气体,有剧毒,存在于多种生产过程以及自然界中。在人体的很多生理过程中也起着重要作用。
资料:①H2S可溶于水约1∶2,其水溶液为二元弱酸。
②H2S可与许多金属离子反应生成沉淀。
③H2S在空气中燃烧,火焰呈淡蓝色。
(1)某化学小组设计了制取H2S并验证其性质的实验,如下图所示。A中是CuSO4溶液,B中放有湿润的蓝色石蕊试纸,C中是FeCl3溶液。
回答下列问题:
①A中有黑色沉淀(CuS)产生,A中发生反应的化学方程式为___________________。
②B中的现象是__________________。
③C中只有浅黄色沉淀产生,且溶液变浅绿色。则C中发生反应的离子方程式为______________。
④D中盛放的试剂可以是________(填字母序号)。
a.水 b.盐酸
c.NaCl溶液 d.NaOH溶液
(2)为进一步探究-2价硫的化合物与+4价硫的化合物反应条件,小明同学又设计了下列实验。
| 实验操作 |
实验现象 |
|
| 实验1 |
将等浓度的Na2S和Na2SO3溶液按体积比2∶1混合 |
无明显现象 |
| 实验2 |
将H2S通入Na2SO3溶液中 |
未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
| 实验3 |
将SO2通入Na2S溶液中 |
有浅黄色沉淀产生 |
已知:电离平衡常数:
H2S Kal=1.3×10-7,Ka2=7.1×10-15
H2SO3 Ka1=1.7×10-2,Ka2=5.6×10-8
①根据上述实验,可以得出结论:在__________条件下,+4价硫化合物可以氧化-2价硫的化合物。
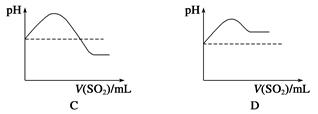
②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是________(填字母序号)。
(3)文献记载,常温下H2S可与Ag发生置换反应生成H2。现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应______。