水煤气是一种工业上常用的气体燃料,一般用焦炭和水蒸气在高温下反应制得,含有少量的
和水蒸气杂质.某化学兴趣小组对水煤气的主要成分进行研究.
【查阅资料】
(1)白色的无水硫酸铜粉末遇水变成蓝色;
(2)
与少量盐酸反应生成
和
,与过量盐酸反应时生成
,
,
【实验假设】
①可燃气只是
②可燃气体只是
③可燃气体是
,
的混合气.
【实验过程】
实验小组按以下流程进行实验(水煤气中
,
已被充分吸收);

实验中,发现黑色氧化铜变红,且
【实验反思】
根据实验结论,甲同学认为实验应保证安全,防止中毒,对尾气的处理方法是
【实验拓展】
(1)实验后,乙同学认为欲检验所用
是否完全消耗,可向溶液中滴入几滴稀盐酸,若没有气体产生,则溶液中还有
剩余,但丙同学认为乙同学的设计是错误的,理由是
(2)丁同学通过本次实验,结合查阅的资料发现,不用任何其它试剂,只用试管和胶头滴管就可以鉴别稀盐酸和碳酸钠两种无色溶液.正确的鉴别方案及结论是
材料:2013年12月2日,“嫦娥三号”探测器由长征三号运载火箭发射,首次实现月球软着陆和月面巡视勘察。12月15日晚,“嫦娥三号”着陆器和巡视器(玉兔月球车)成功分离,顺利互拍,任务取得圆满成功。长征三号运载火箭主要用于发射地球同步轨道有效载荷,它的一子级和二子级使用偏二甲肼(C2H8N2)和四氧化二氮(N2O4)作推进剂,三子级则使用效能更高的液氢(H2)和液氧(O2)。
(1)“长征三号”三子级火箭用液氢做燃料,其反应的化学方程式为,使用液氢做燃料的优点有:(填一条)。
(2)下列有关偏二甲肼(C2H8N2)的叙述正确的是
| A.由2个碳原子,4个氢原子,一个氮分子组成 |
| B.由碳、氢、氮三种元素组成 |
| C.由2个碳原子,8个氢原子,2个氮原子构成 |
| D.偏二甲肼分子中碳、氢、氮的原子个数比为1:4:1 |
(3)“玉兔”月球车(下图)主体为长方形盒状,车底安有六个轮状的移动装置,顶部两片太阳翼可以打开,太阳翼打开可将太阳能转化成能,为“玉兔”提供能源的还有锂电池和核电池。“玉兔号”对“车轮”要求极高。月球车底盘和车轮由铝合金材料制成,这是由于铝合金具有质轻坚硬的特性。
(4)看见玉兔车金灿灿的车身后,小聪想到家里新换的水龙头。他从说明书上了解到该水龙头是铜质镀铬。好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,请你参与。
【作出猜想】
猜想1.Cr>Fe>Cu;猜想2.Fe>Cu >Cr;猜想3.你的猜想是。
【查阅资料】
① 铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜。
② 铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液。
【设计与实验】
小聪同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的同种稀硫酸。
| 实验 |
试管1 |
试管2 |
试管3 |
| 实验 操作 |
 |
 |
 |
| 实验 现象 |
铁片表面产生气泡较慢,溶液变为浅绿色 |
铬片表面产生气泡较快,溶液变成为蓝色 |
【结论与解释】
① 小聪得到的结论是猜想正确。
② 实验前用砂纸打磨金属片的目的是。
【知识运用】
将铬片投入FeSO4溶液中,反应(填“能”或“不能”)进行。若能进行,请你写出。
【实验探究】
(1)请你依据下图设计一个酸和碱反应的探究实验: 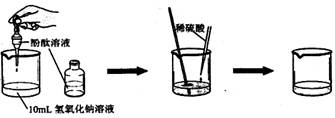
| 实验步骤 |
实验现象 |
结论 |
| ①向烧杯中加入10mL氢氧化钠溶液,并滴入几滴酚酞试液 ②再用滴管慢慢滴入稀硫酸,并不断搅拌溶液。 |
①溶液颜色 ; ②不断搅拌溶液至溶液颜色变成 色。 |
酸和碱发生了中和反应 |
(2)为探究上述酸、碱反应后硫酸是否过量,甲、乙、丙三位同学设计了以下方案:
| 实验方案 |
实验步骤 |
实验现象 |
实验结论 |
| 甲同学的方案 |
取样,滴入适量的氯化钡溶液 |
出现白色沉淀 |
硫酸过量 |
| 乙同学的方案 |
取样,滴入几滴无色酚酞溶液 |
酚酞溶液不变色 |
酸、碱恰好完全反应 |
| 丙同学的方案 |
取样,滴入几滴紫色石蕊溶液 |
溶液变红 |
硫酸过量 |
【实验评价】
①三个方案中只有 是正确的(填“甲”、“乙”、“丙”)。
②请分析另外两个同学方案错误的原因:
一个错误的原因是 ,
另一个错误的原因是 。
【实验反思】探究硫酸和氢氧化钠反应后硫酸是否有剩余,还可选择一种试剂
某小组同学将BaCl2溶液与H2SO4溶液混合,将反应后的液体过滤,并探究滤液的成分,请你参与探究并回答相关问题。
【问题与发现】Ⅰ.BaCl2溶液与H2SO4溶液混合,发生反应的化学方程式是:。
Ⅱ.滤液里的溶质是什么?
【猜想与假设】
猜想1:滤液里的溶质只有HCl;
猜想2:滤液里的溶质有HCl和H2SO4;
猜想3:滤液里的溶质有HCl和。
【探究与验证】
| 实验操作 |
现象 |
结论 |
|
| 甲 |
取少量滤液,加入少量锌粒 |
有气泡产生 |
猜想2成立 |
| 乙 |
取少量滤液,加入少量的Na2SO4溶液 |
猜想3成立 |
【反思与评价】经过小组讨论,分析出_(填甲或乙)的结论是错误的,应该将药品更换成(填序号)。
A.AgNO3溶液 B.Ba(NO3)2溶液 C.Na2CO3溶液 D.Mg
在化学课上,甲同学将燃烧的钠迅速伸入到盛有CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质。
【提出问题】黑色颗粒和白色物质是什么?
【进行猜想】甲认为黑色颗粒是 ,白色物质可能是Na2O或Na2CO3或 ,乙同学还认为白色物质是氢氧化钠。
甲同学立刻认为乙同学的猜想是错误的,其理由是:。
【查阅资料】氧化钠为白色粉末,溶于水生成氢氧化钠: Na2O+H2O ="=" 2NaOH
【实验探究】甲同学对白色物质进行实验探究。
| 实验方案 |
实验操作 |
实验现象 |
结论 |
| 方案1 |
取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 |
溶液变成红色 |
白色物质 为Na2O |
| 方案2 |
①取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 |
出现白色沉淀 |
白色物质 是。 |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 |
无明显现象 |
【反思评价】丙同学认为方案1得到的结论不正确,其理由是。
【得出结论】钠在二氧化碳中燃烧的化学方程式为:。
化学兴趣小组同学在实验室发现了四瓶长期存放且失去标签的溶液,现标为A、B、C、D,分别是碳酸钠溶液、氯化钡溶液、氢氧化钠溶液和稀硫酸中的一种。
【提出问题】如何区分出四种溶液?
【进行实验】组长楠楠同学的实验如图所示:
【表达与交流】楠楠同学取少量A溶液,滴加足量的稀盐酸,观察到溶液中有气泡产生,楠楠同学由此得出结论:A是碳酸钠溶液。
萍萍同学不同意楠楠的观点,她的理由是(1)。
经过交流,两人一起制订了新的实验方案:另取少量A于试管中,向其中滴加 (2)溶液,观察到的明显现象是(3),
过滤后,取清液滴加无色酚酞溶液,溶液变为红色,由此证明了楠楠同学的结论是错误的,同时确定了A。
两位同学取B、C、D样品继续进行实验,如图所示:
【收集证据】观察到B中无明显现象,C中紫色石蕊溶液变红,D中紫色石蕊溶液变蓝。
【解释与结论】通过实验,两位同学最终区分出了四种溶液。请将B、C、D三瓶溶液中
溶质的化学式分别标在试剂瓶的标签上(4)
【反思与评价】你认为楠楠和萍萍两位同学在上述实验过程中表现出的长处是
(5)。(写一点即可)