【实验探究】
(1)请你依据下图设计一个酸和碱反应的探究实验: 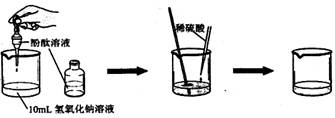
| 实验步骤 |
实验现象 |
结论 |
| ①向烧杯中加入10mL氢氧化钠溶液,并滴入几滴酚酞试液 ②再用滴管慢慢滴入稀硫酸,并不断搅拌溶液。 |
①溶液颜色 ; ②不断搅拌溶液至溶液颜色变成 色。 |
酸和碱发生了中和反应 |
(2)为探究上述酸、碱反应后硫酸是否过量,甲、乙、丙三位同学设计了以下方案:
| 实验方案 |
实验步骤 |
实验现象 |
实验结论 |
| 甲同学的方案 |
取样,滴入适量的氯化钡溶液 |
出现白色沉淀 |
硫酸过量 |
| 乙同学的方案 |
取样,滴入几滴无色酚酞溶液 |
酚酞溶液不变色 |
酸、碱恰好完全反应 |
| 丙同学的方案 |
取样,滴入几滴紫色石蕊溶液 |
溶液变红 |
硫酸过量 |
【实验评价】
①三个方案中只有 是正确的(填“甲”、“乙”、“丙”)。
②请分析另外两个同学方案错误的原因:
一个错误的原因是 ,
另一个错误的原因是 。
【实验反思】探究硫酸和氢氧化钠反应后硫酸是否有剩余,还可选择一种试剂
实验室用溶质质量分数为10%氢氧化钠溶液进行水的电解实验.
实验一:配制100g溶质质量分数为10%氢氧化钠溶液.
(1)所需的氢氧化钠质量: g;
(2)称量时,氢氧化钠固体应放于天平 (填“左”或“右”)盘的烧杯内;量取的需的水(水的密度为1g/cm3),应选择的量筒的规格是 mL(选填“10”、“100”或“250”).
实验二:水的电解实验
用如图装置进行水的电解实验.已知氢氧化钠在水的电解实验中,只起到增强水的导电性作用.
(3)开始反应前a,b两管内都充满溶液.关闭活塞,接通电源,一段时间后,两管产生的气体如图所示,则a管下方导线应接电源的 极(填“正”或“负”).用 验证b管中的气体,写出电解水的化学方程式: .
(4)说明水是一种化合物的实验事实: .
(5)电解后溶液的溶质质量分数 10%(填“<”、“=”或“>”).
下图装置用于制取某些气体。
(1)填写下列仪器的名称:
a:;
b:。
(2)若用
制取氧气,反应的化学方程式为,应选择的发生装置是(填序号),不能选用的收集装置是(填序号)。
(3)虽然常温常压下乙烯(
)不与空气反应,但因密度很接近空气而不用排空气法收集。若用排空气法收集乙烯,将;排水法收集乙烯时,待导气管口连续稳定地冒出气泡才开始收集,原因是。
3.某兴趣小组做以下实验探究分子的运动,请完成实验中的有关问题。
(1)实验一:在盛有少量蒸馏水的小烧杯中滴入2至3滴酚酞试液,再向其中滴加浓氨水。由实验一得出的结论有:___________________________________________。
(2)实验二(如图甲所示):烧杯B中的现象是:_______________________________________,产生这一现象的原因是:___________________________________________。
(3)为使实验结论准确可靠,该兴趣小组设计实验三(如图乙所示)作为对比实验,你认为有无必要?理由是:___________________________________________。
在一次探究成果汇报课上,某同学展示了她的探究实验:取一瓶无色的硫化氢(H2S)气体和一瓶无色的二氧化硫气体(SO2),然后瓶口对瓶口抽去玻璃片放置(如图所示),一段时间后,两瓶的内壁上均出现水珠,并且有淡黄色的细微颗粒物附在瓶内壁上(已知是硫单质)。试分析此同学的探究活动取得了哪些成果。
小明同学在帮老师整理实验室时,发现一瓶石灰水试剂瓶瓶壁和瓶塞周围有一些白色粉末。为了弄清楚白色粉末的成分及形成原因,他进行了如下探究:
(1)对白色粉末成分的猜想和成因分析:
| 白色粉末的成分 |
形成的原因 |
| 可能是CaCO3 |
石灰水与空气中的某种气体发生了化学反应,其化学方程式为________________________________________。 |
| 可能是Ca(OH)2 |
瓶壁和瓶塞处的石灰水中的溶剂蒸发,溶质结晶析出 |
(2)经过反复思考,小明同学猜想白色粉末还可能是上述两种物质的混合物。
为了得出比较严格的结论,他用刀片轻轻刮下少许白色粉末置于试管中,并滴入少量蒸馏水,进行了如下实验来验证他的猜想,请完成下列实验报告:
| 实验步骤 |
实验现象 |
结论 |
| 向试管中滴入1-2滴无色酚酞试液 |
____________ |
白色粉末中含有氢氧化钙 |
| 往上述试管中的残留固体中加入稀盐酸 |
____________ |
白色粉末中含有碳酸钙 |
(3)反思与交流:实验室里许多药品需要密封保存。请你写出浓硫酸需要密封保存的原因
。
(4)拓展与提高:若想清洗石灰水试剂瓶内壁和瓶塞处的白色粉末,可选用的试剂是______
(填试剂名称),其反应的化学方程式为__________________________________________。