硫酸铜是一种应用广泛的化工原料,实验室中可通过不同途径制取硫酸铜溶液和胆矾(CuSO4·5H2O),其中一种流程如下:
(1)操作I具体为__________、___________、过滤、烘干。
(2)杂铜(含少量有机物)灼烧后的产物除氧化铜还含少量铜,原因可能是___________(填字母代号)。
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分.铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(3)若将杂铜换为纯净的铜粉,可直接向其中加入稀硫酸和Fe2(SO4)3溶液,不断通入氧气。反应完全后向其中加入过量_______________(填化学式,下同),调节pH至4,生成_________沉淀,过滤得硫酸铜溶液[已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7、6.4]。
(4)通过下述图1装置也可制取硫酸铜溶液(已知:2NaOH+2NO2=NaNO3+NaNO2+H2O)。
烧瓶内发生反应的离子方程式为____________________________________________;
图2是图1的改进装置,其优点有①__________________________,②_________________________。
(7分) “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯。回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式
(2)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是:。
(3)浓硫酸的作用是:①;②。
(4)饱和碳酸钠溶液的主要作用是
。
(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
某气态烃A在标准状况下的密度为1.25g/L,其产量可以用来衡量一个国家的石油化工发展水平。B和D都是生活中常见的有机物,D能跟碳酸氢钠反应,F有香味。它们之间的转化关系如下图所示:


 (1)A的结构式为 ,B中官能团的电子式为 ,
(1)A的结构式为 ,B中官能团的电子式为 , D中官能团的名称为 。
D中官能团的名称为 。 (2)反应①的反应类型是 ,
(2)反应①的反应类型是 ,
反应③的化学方程式为 。
。

 (3)反应②在Cu做催化剂的条件下进行,该实验的步骤是将红亮的铜丝置于酒精灯上加热,待铜丝变为黑色时,迅速将其插入到装有B的试管中(如图所示)。重复操作2-3次,观察到的现象是 。该反应的化学方程式为 。
(3)反应②在Cu做催化剂的条件下进行,该实验的步骤是将红亮的铜丝置于酒精灯上加热,待铜丝变为黑色时,迅速将其插入到装有B的试管中(如图所示)。重复操作2-3次,观察到的现象是 。该反应的化学方程式为 。 (4)D与碳酸氢钠溶液反应的离子方程式为 。
(4)D与碳酸氢钠溶液反应的离子方程式为 。 (5)B、D在浓硫酸的作用下实现反应④,实验装置如下图所示:
(5)B、D在浓硫酸的作用下实现反应④,实验装置如下图所示:
 试管1中装药品的顺序为先取 (填“B”、“D”、“浓硫酸”,下同),再加入 ,最后加入 。图中X的化学式为 。
试管1中装药品的顺序为先取 (填“B”、“D”、“浓硫酸”,下同),再加入 ,最后加入 。图中X的化学式为 。 浓硫酸的作用是 。
浓硫酸的作用是 。 该反应的化学方程式为 。
该反应的化学方程式为 。
二乙酸—1,4—环己二醇酯可通过下列路线合成:
(1)上述合成过程中没有涉及的反应类型是 ▲
| A.加成 | B.消去 | C.取代 | D.氧化E.聚合 F.酯化 |
(2)与 互为同分异构体,满足条件:①能发生银镜反应和酯化反应;②
互为同分异构体,满足条件:①能发生银镜反应和酯化反应;②
所有碳原子在一条直链上的同分异构体有 ▲种。
(3)写出②的反应方程式 ▲;
写出⑤的反应方程式 ▲。
(4)请设计合理的方案以CH2=CH—CH=CH2(1,3—丁二烯)和醋酸为原料合成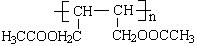 (用合成路线流程图表示,并注明反应条件)。
(用合成路线流程图表示,并注明反应条件)。
提示:①合成过程中无机试剂任选; ②合成路线流程图示例如下:
CH3CH2OH  H2C=CH2
H2C=CH2
▲
某有机物A,由C、H、O三种元素组成,在一定条件下,A、B、C、D、E、F具有下列转化关系:
已知D的蒸气密度是氢气的29倍,并可以发生银镜反应。
(1)写出F的结构简式 ▲;
(2)写出C → A的反应条件 ▲;
(3)写出A → D的反应方程式 ▲。
写出B → C的反应方程式 ▲。
根据要求回答下列问题。
(1)分子球棍模型可以帮助人们认识有机物的结构。
下列是某有机物的分子比例模型,其中不同颜色的球代表不同的原子,球之间的“棍”
表示单键、双键或三键。
该有机物分子中可能存在的两种官能团的名称分别为 ▲、 ▲;
这类有机物在化学性质上表现的特点是 ▲。
(2)有机物的特征性质常可用以有机物之间的鉴别。
①欲区分葡萄糖和淀粉,可选用 ▲(填字母)。
A.碘水 B.银氨溶液 C.盐酸 D.NaOH溶液
②欲区分 和
和 ,可选用 ▲(填字母)。
,可选用 ▲(填字母)。
A.AgNO3溶液 B.NaOH溶液 C.FeCl3溶液 D.Na2CO3溶液
(3)同分异构现象是有机物种类繁多的原因之一。
分子式为C7H6O2的有机物有多种同分异构体,其中含有苯环和1个侧链的同分异构体的结构简式是 ▲、 ▲……。
(4)高分子化合物在生产、生活中有着广泛的应用。
PES(聚丁二酸乙二醇酯)是一种生物可降解的聚酯,它在塑料薄膜,食品包装等方面有着广泛的应用。其结构简式如下:
合成PES的有机化学反应类型是 ▲反应。形成该聚合物的两种单体的结构简式分别是 ▲和 ▲。