(7分) “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯。回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式
(2)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是: 。
(3)浓硫酸的作用是:① ;② 。
(4)饱和碳酸钠溶液的主要作用是
。
(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
(一)制取氧化铜
①往盛有一定量CuCl2溶液的烧杯中逐滴加入NaOH溶液,直至不再产生沉淀,然后将烧杯中的物质转移到蒸发皿中,加热至沉淀全部变为黑色。
②将步骤①所得的黑色沉淀过滤、洗涤,晾干后研细备用。
(1)在实验过程中,若未加入NaOH溶液,直接将CuCl2溶液转移到蒸发皿中加热,最后也能得到黑色沉淀,试分析其原因_________________________________________________
(2)写出检验步骤②中沉淀是否洗涤干净的操作_____________________________________
(二)为证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较,用下图装置进行实验,每次实验时均收集25ml气体,其他可能影响实验的因素均已忽略,实验数据见下表: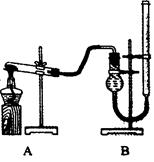
| 实验序号 |
KClO3质量 |
其他物质质量 |
待测数据 |
| ③ |
1.2g |
无其他物质 |
a |
| ④ |
1.2g |
CuO 0.5g |
b |
| ⑤ |
1.2g |
MnO2 0.5g |
c |
(3)写出氯酸钾分解反应的化学方程式,并用双线桥表示电子转移的方向和数目。
(4)上述实验中的“待测数据”是指________________________________________
(5)图中量气装置B由干燥管、乳胶管和50ml滴定管改造后组装面成,此处用滴定管是________(填“酸式”或“碱式”)滴定管
(6)若实验证明氧化铜加快氯酸钾的分解效果比用二氧化锰差,请结合上表的实验效果数据,在坐标图中分别画出使用CuO、MnO2作催化剂时产生氧气的体积﹝V(O2)﹞随时间(t)变化的曲线(注明必要的标识)。
(7分)实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁[Fe2(OH)n(SO4)3—n/2]m和绿矾(FeSO4·7H2O),其过程如下:
(1)过程①中,FeS和O2、H2SO4反应的化学方程式是。
(2)验证固体W焙烧后产生的气体含有SO2的方法是。
(3)制备绿矾时,向溶液X中加入过量,充分反应后,经操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾。
(4)溶液Z的pH将影响聚铁中铁的质量分数,若溶液Z的pH偏小,将导致聚铁中铁的质量分数偏(填“高”或“低”),过程②中将溶液加热到70~80 ℃的目的是。
实验室常用苯甲醛在浓氢氧化钠溶液中制备苯甲醇和苯甲酸,反应如下:
已知:
①苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、0.95g(60℃)、6.8g(95℃)。
②乙醚沸点34.6℃,密度0.7138,易燃烧,当空气中含量为1.83~48.0%时易发生爆炸。
③石蜡油沸点高于250℃
④苯甲醇沸点为205.3℃
实验步骤如下:
①向图l所示装置中加入8g氢氧化钠和30mL水,搅拌溶解。稍冷,加入10 mL苯甲醛。开启搅拌器,调整转速,使搅拌平稳进行。加热回流约40 min。
②停止加热,从球形冷凝管上口缓缓加入冷水20 mL,摇动均匀,冷却至室温。然后用乙醚萃取三次,每次10 mL。水层保留待用。合并三次萃取液,依次用5 mL饱和亚硫酸氢钠溶液洗涤,10 mL 10%碳酸钠溶液洗涤,10 mL水洗涤,然后分液,将水层弃去,所得醚层进行实验步骤③。
③将分出的醚层,倒入干燥的锥形瓶中,加无水硫酸镁,注意锥形瓶上要加塞。将锥形瓶中溶液转入图2所示的蒸馏装置,先缓缓加热,蒸出乙醚;蒸出乙醚后必须改变加热方式、冷凝方式,继续升高温度并收集205℃~206℃的馏分得产品A。
④将实验步骤②中保留待用的水层慢慢地加入到盛有30 mL浓盐酸和30 mL水的混合物中,同时用玻璃棒搅拌,析出白色固体。冷却,抽滤,得到粗产品,然后提纯得产品B。
根据以上步骤回答下列问题:
(1)步骤②萃取时用到的玻璃仪器除了烧杯、玻璃棒外,还需(仪器名称)。
(2)步骤②中饱和亚硫酸氢钠溶液洗涤是为了除去,而用碳酸钠溶液洗涤是为了除去醚层中极少量的苯甲酸。醚层中少量的苯甲酸是从水层转移过来的,请用离子方程式说明其产生的原因。
(3)步骤③中无水硫酸镁的作用是,锥形瓶上要加塞的原因是,产品A为。
(4)步骤③中蒸馏除去乙醚的过程中采用的加热方式为;蒸馏得产品A的加热方式是。
(5)步骤④中提纯产品B时所用到的实验方法为。
B.草酸二乙酯可用于苯巴比妥等药物的中间体,实验室以草酸(HOOC—COOH)和乙醇为原料制备草酸二乙酯的实验步骤如下: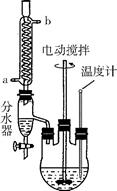
步骤1:在上图所示装置中,加入无水草酸45g,无水乙醇81g,苯200mL,浓硫酸10mL,搅拌下加热6870℃回流共沸脱水。
步骤2:待水基本蒸完后,分离出乙醇和苯。
步骤3:所得混合液冷却后依次用水、饱和碳酸氢钠溶液洗涤,再用无水硫酸钠干燥。
步骤4:常压蒸馏,收集182-184℃的馏分,得草酸二乙酯57g。
(1)步骤1中发生反应的化学方程式是,反应过程中冷凝水应从(填“a”或“b”)端进入。
(2)步骤2操作为。
(3)步骤3用饱和碳酸氢钠溶液洗涤的目的是。
(4)步骤4除抽气减压装置外所用玻璃仪器有蒸馏烧瓶、冷凝管、接液管、锥形瓶和。
(5)本实验中,草酸二乙酯的产率为。
(15分)草酸镍晶体(NiC2O4·2H2O)可用于制镍催化剂,硫酸镍晶体(NiSO4·7H2O)主要用于电镀工业。某小组用废镍催化剂(成分为Al2O3、Ni、Fe、SiO2、CaO等)制备草酸镍晶体的部分实验流程如下:
已知:①相关金属离子生成氢氧化物沉淀的pH如下表(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。
| 金属离子 |
开始沉淀的pH |
沉淀完全的pH |
| Fe3+ |
1.1 |
3.2 |
| Fe2+ |
5.8 |
8.8 |
| Al3+ |
3.0 |
5.0 |
| Ni2+ |
6.7 |
9.5 |
②Ksp(CaF2)=1.46×10-10,Ksp(CaC2O4)=2.34×10-9。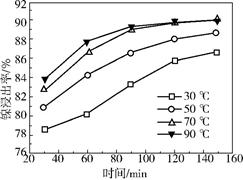
(1)“粉碎”的目的是。
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如右图。“酸浸”的适宜温度与时间分别为(填字母)。
a.30℃、30min
b.90℃、150min
c.70℃、120min
d.90℃、120min
(3)证明“沉镍”工序中Ni2+已经沉淀完全的实验步骤及现象是。
(4)将“沉镍”工序得到的混合物过滤,所得固体用乙醇洗涤、110 ℃下烘干,得草酸镍晶体。
①用乙醇洗涤的目的是。
②烘干温度不超过110℃的原因是。
(5)由流程中的“浸出液”制备硫酸镍晶体的相关实验步骤如下:
第1步:取“浸出液”,,充分反应后过滤,以除去铁、铝元素;
第2步:向所得滤液中加入适量NH4F溶液,充分反应后过滤,得“溶液X”;
第3步:,充分反应后过滤;
第4步:滤渣用稍过量硫酸充分溶解后,蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得硫酸镍晶体。
①请补充完整相关实验步骤(可选试剂:H2SO4溶液、NaOH溶液、HNO3溶液、H2O2溶液)。
②第2步中加入适量NH4F溶液的作用是。