煤是重要的能源,也是化工生产的重要原料。
(1)煤燃烧产生的废气直接排放到空气中,可能导致的环境污染问题是_____________。
(2)下图是对煤矿燃烧产生的废气进行常温脱硫处理的流程示意图。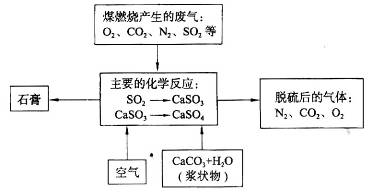
①废气脱硫过程中,主要反应的化学方程式为______________、_____________;
②在煤矿中直接添加一种物质,可有效减少煤矿燃烧产生的SO2,该物质是___________;
③石膏的工业生产中的用途是_________________(写出一种用途即可)。
(3)煤经过___________(填加工方法)可以得到焦炉煤气、煤矿焦油和焦炭。煤焦油经过_______(填加工方法)可得到芳得族化合物。煤矿也可以用氢化法转化燃油,氢化法的本质是__________________。
菱锌矿的主要成分是碳酸锌,还含有少量的Fe2O3、FeO、CuO等杂质。如图是以菱锌矿为原料制取轻质氧化锌的一种工艺流程,该流程还可以得到两种副产品——海绵铜和铁红。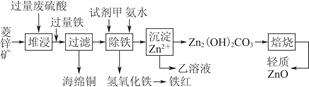
请结合下表数据,回答问题:
| 离子 |
开始沉淀时的pH |
完全沉淀时的pH |
| Fe2+ |
6.3 |
9.7 |
| Fe3+ |
1.5 |
3.2 |
| Zn2+ |
6.2 |
8.0 |
(1)下列试剂中,________(填代号)可作为试剂甲的首选。
A.KMnO4 B.Cl2 C.H2O2 D.浓硝酸
根据所选试剂写出与之反应的离子方程式:________________________________________________________________________________________________________________________________________________。
(2)氢氧化铁固体会吸附一些SO42-,如何洗涤Fe(OH)3固体以及如何判断是否洗涤干净?
洗涤方法:______________________________________________________________,判断是否洗涤干净的方法是_______________________________________。
(3)除铁步骤中加入氨水的目的是调节溶液的pH,其适宜的pH范围是______________;调节溶液pH时,除了氨水外,还可以加入下列物质中的________。
a.Zn b.ZnO c.Zn(OH)2 d.CuO
(4)经测定乙溶液中仍含有少量的Fe3+和Zn2+。若c(Fe3+)为4.0×10-17 mol·L-1,则c(Zn2+)为______________ mol·L-1。(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Zn(OH)2]=1.2×10-17)。
合成氨工业生产中所用的αFe催化剂的主要成分是FeO、Fe2O3。
(1)某FeO、Fe2O3混合物中,铁、氧的物质的量之比为4∶5,其中Fe2+与Fe3+物质的量之比为________。
(2)当催化剂中Fe2+与Fe3+的物质的量之比为1∶2时,其催化活性最高,此时铁的氧化物混合物中铁的质量分数为________(用小数表示,保留2位小数)。
(3)以Fe2O3为原料制备上述催化剂,可向其中加入适量碳粉,发生如下反应:2Fe2O3+C 4FeO+CO2↑。
4FeO+CO2↑。
已知A~G有如图所示的转化关系(部分生成物已略去),其中A、G为单质,D是能使湿润的红色石蕊试纸变蓝色的气体,E、F均能与NaOH溶液反应。
请回答下列问题:
(1)写出F的电子式:____________。
(2)①C溶液与D反应的离子方程式为________________________________________________________________________________________________________________________________________________;
②F溶液与NaOH溶液共热反应的化学方程式为________________________________________________________________________________________________________________________________________________。
(3)①请用离子方程式解释C溶液为何显酸性:________________________________________________________________________________________________________________________________________________,
②F溶液中离子浓度由大到小的顺序为________________________________________________________________________。
(4)将5.4 g A投入200 mL 2.0 mol/L某溶液中有G单质产生,且充分反应后有金属剩余,则该溶液可能是________(填代号)。
A.HNO3溶液B.H2SO4溶液 C.NaOH溶液 D.HCl溶液
(5)将1 mol N2和3 mol G及催化剂充入容积为2 L的某密闭容器中进行反应,已知该反应为放热反应。平衡时,测得D的物质的量浓度为a mol/L。
①如果反应速率v(G)=1.2 mol/(L·min),则v(D)=________mol/(L·min)。
②在其他条件不变的情况下,若起始时充入0.5 mol N2和1.5 mol G达到平衡后,D的物质的量浓度________(填“大于”“小于”或“等于”) mol/L。
mol/L。
③该条件下的平衡常数为__________________(用含a的代数式表示)。
铜是生物体必需的微量元素,也是人类最早使用的金属之一。铜的生产和使用对国计民生各个方面都产生了深远的影响。
(1)写出铜与稀硝酸反应的化学方程式:________________________________________________________________________________________________________________________________________________。
(2)为了保护环境和节约资源,通常先用H2O2和稀硫酸的混合溶液溶出废旧印刷电路板中的铜,最终实现铜的回收利用。写出溶出铜的离子方程式:________________________________________________________________________________________________________________________________________________。
(3)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2↑,该反应的氧化剂是______________;当生成19.2 g Cu时,反应中转移的电子为__________mol。
6Cu+SO2↑,该反应的氧化剂是______________;当生成19.2 g Cu时,反应中转移的电子为__________mol。
(4)铜在潮湿的空气中能发生吸氧腐蚀而生锈,铜锈的主要成分为Cu2(OH)2CO3(碱式碳酸铜)。试写出上述过程中负极的电极反应式:________________________________________________________________________________________________________________________________________________。
(5)研究性学习小组用“间接碘量法”测定某试样CuSO4·5H2O(不含能与I-反应的氧化性杂质)的含量。取a g试样配成100 mL溶液,每次取25.00 mL,滴加KI溶液后有白色碘化物沉淀生成。写出该反应的离子方程式:___________________________。继续滴加KI溶液至沉淀不再产生,溶液中的I2用硫代硫酸钠标准溶液滴定,发生反应的化学方程式为I2+2Na2S2O3=2NaI+Na2S4O6,平均消耗c mol/L的Na2S2O3溶液V mL。则试样中CuSO4·5H2O的质量分数为______________。
实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下:
(1)将过程②中产生的气体通入下列溶液中,溶液会褪色的是________。
A.品红溶液B.紫色石蕊溶液
C.酸性KMnO4溶液D.溴水
(2)过程①中,FeS和O2、H2SO4反应的化学方程式为_____________________________。
(3)过程③中,需加入的物质是________。
(4)过程④中,蒸发结晶需要使用酒精灯、三脚架、泥三角,还需要的仪器有________________。
(5)过程⑤调节pH可选用下列试剂中的________(填选项序号)。
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70~80 ℃,目的是______________________。
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。
①用分析天平称取2.700 g样品;
②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;