(10分)某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均己略去) 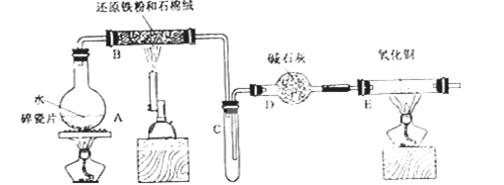
(1)装置B中发生反应的化学方程式是___________________________。
(2)装置E中的现象是________________________________________。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法:________________________。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
滤液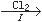 FeCl3溶液
FeCl3溶液 FeCl3·6H2O晶体
FeCl3·6H2O晶体
①步骤Ⅰ中通入Cl2的作用是____________________________________。
②该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)_______________。
已知1mol CO气体完全燃烧生成CO2气体,放出283KJ热量,1mol氢气完全燃烧生成液态水放出286KJ热量,1mol CH4气体完全燃烧生成CO2气体和液态水放出890KJ热
(1)写出H2燃烧热的热化学方程式。
(2)若1mol CH4气体完全燃烧生成CO2气体和水蒸汽,放出热量890KJ(填“=”、“>”“<”)
(3)若将a mol CH4,CO,H2混合气体完全燃烧,生成CO2气体和液态水,则放出热量(Q)的取值范围是。
(4)若将a mol CH4,CO,H2混合气体完全燃烧,生成CO2气体和液态水,且CO2和H2O物质的量相等,则放出热量(Q)的取值范围是。
依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。
则表示甲醇燃烧热的热化学方程式为_____________________________________;
(2)若适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ热量。______________________________;
(3)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量_________________________________。
(4)肼(N2H4)和NO2是一种双组分火箭推进剂。两种物质混合发生反应生成N2和H2O(g),已知8g气体肼在上述反应中放出142kJ热量,其热化学方程式为。
A、B、C、D、E 5瓶透明溶液,分别是HCl 、BaCl2、NaHSO4、Na2CO3、AgNO3溶液中的一种。
①A 与B反应有气体生成② B与C反应有沉淀生成③C与D反应有沉淀生成④D与E反应有沉淀生成⑤A与E反应有气体生成
⑥在②和③的反应中生成的沉淀是同一种物质B是_________D是_________(均填化学式)
下列物质:①铜丝②碳酸③氯化氢气体④稀硝酸⑤二氧化硫气体⑥氨水⑦蔗糖晶体⑧熔融氯化钠⑨氧化钠固体⑩硫酸铜晶体(用相应序号填空)
⑴上述物质可导电的是_________________⑵属于电解质的是__________________
(3)属于强电解质的是
(12分)在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+O2(g)  2SO3(g) ΔH<0
2SO3(g) ΔH<0
(1) 写出该反应的化学平衡常数表达式K=______ ____。降低温度,该反应K值___ ___,二氧化硫转化率______,化学反应速率______。(以上均填“增大”“减小”或“不变”)
(2) 600 ℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图所示,反应处于平衡状态的时间是________。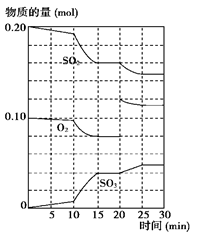
(3)据上图判断,反应进行至20 min时,曲线发生变化的原因是________________ ___________________(用文字表达);10 min到15 min的曲线变化的原因可能是________(填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量
(4)已知在600℃时,2SO2(g)+O2(g)  2SO3(g)的平衡常数K=19,若600℃时测得容器内c(SO2)=0.3mol/L,c(O2)=0.1mol/L,c(SO3)=0.4mol/L,在这种情况下,该反应是否处于平衡状态?(填“是”或“否”)。此时,化学反应速率是v(正)v(逆)(填“>”、“<”或“=”),原因是。
2SO3(g)的平衡常数K=19,若600℃时测得容器内c(SO2)=0.3mol/L,c(O2)=0.1mol/L,c(SO3)=0.4mol/L,在这种情况下,该反应是否处于平衡状态?(填“是”或“否”)。此时,化学反应速率是v(正)v(逆)(填“>”、“<”或“=”),原因是。