硼及其化合物在耐髙温合金工业、催化剂制造、髙能燃料等方面应用广泛。
(1)氮化硼是一种耐高温材料,巳知相关反应的热化学方程式如下:
2B(s)+N2(g)= 2BN(s) ΔH="a" kJ • mol-1
B2H6 (g)=2B(s) + 3H2 (g) ΔH =b kJ • mol-1
N2 (g) + 3H2 (g) 2NH3 (g) ΔH ="c" kJ• mol-1
2NH3 (g) ΔH ="c" kJ• mol-1
①反应B2H6(g)+2NH3(g)=2BN(s)+6H2(g) ΔH = (用含a、b、c的代数式表示)kJ ·mol-1。
②B2H6是一种髙能燃料,写出其与Cl2反应生成两种氯化物的化学方程式: 。
(2)硼的一些化合物的独特性质日益受到人们的关注。
①最近美国化学家杰西·萨巴蒂尼发现由碳化硼制作的绿色焰火比传统焰火(硝酸钡)更安全,碳化硼中硼的质量分数为78. 6%,则碳化硼的化学式为 。
②近年来人们将LiBH4和LiNH2球磨化合可形成新的化合物Li3BN2H8和Li4BN3 H10,Li3BN2H8球磨是按物质的量之比n(LiNH2) : n(LiBH4) =" 2" : 1加热球磨形成的,反应过程中的X衍射图谱如图所示。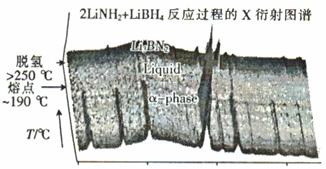
Li3BN2H8在大于250℃时分解的化学方程式为 ,Li3BN2H8与Li4BN3H10的物质的量相同时,充分分解,放出等量的H2,Li4BN3 H10分解时还会产生固体Li2NH和另一种气体,该气体是 。
(3)直接硼氢化物燃料电池的原理如图,负极的电极反应式为 。电池总反应的离子方程式为 。
研究有机物一般经过以下几个基本步骤:分离、提纯 → 确定实验式 → 确定分子式 → 确定结构式。
已知:① 2R-COOH + 2Na → 2R-COONa + H2 ↑
② R-COOH + NaHCO3 → R-COONa + CO2↑ + H2O
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| 实 验 步 骤 |
解 释 或 实 验 结 论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
试通过计算填空: (1)A的相对分子质量为 。 |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 |
(2)A的分子式为 。] |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 |
(3)用结构简式表示A中含有的官能团。 |
(4)A的核磁共振氢谱如下图: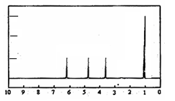 |
(4)A中含有 种氢原子。 综上所述, A的结构简式为 。 |
碳氧化物的转化有重大用途,回答关于CO和CO2的问题。
(1)己知:①C (s) + H2O(g) CO (g) +H2 (g)△H1
CO (g) +H2 (g)△H1
②2CO(g) + O2(g) = 2CO2 (g) △H2
③H2O (g)= H2 (g) +1/2 O2 (g) △H3
则C (s) + O2 (g) =CO2 (g)的△H = (用△H1、△H2、△H3表示)。
(2)对于化学平衡①,在不同温度下,CO的浓度与反应时间的关系如图所示,
由图可得出如下规律:随着温度升高,① ;② 。
(3)某温度下,将6.0 mol H2O(g)和足量碳充入3 L的恒容密闭容器中,发生如下反应:C(s) + H2O(g) CO(g) +H2 (g),达到平衡时测得lgK=-1.0(K为平衡常数),求平衡时H2O(g)的转化率?(写出计算过程)
CO(g) +H2 (g),达到平衡时测得lgK=-1.0(K为平衡常数),求平衡时H2O(g)的转化率?(写出计算过程)
(4)在神州九号飞船中,宇航员呼出的CO2也可以采用Na2O2吸收,写出相关的化学方程式并标明电子转移的方向和数目: 。
2013年12月15日4时搭载长征系列火箭的“玉兔号”顺利驶抵月球表面,实现了五星红旗耀月球的创举。火箭升空需要高能燃料,通常用肼(N2H4)作燃料,N2O4做氧化剂。请回答下列问题:
(1)已知:N2(g) + 2O2(g) ="=" 2NO2(g)ΔH=+67.7kJ·mol-1
N2H4(g) + O2(g)="=" N2(g) + 2H2O(g)ΔH=-534.0kJ·mol-1
2NO2(g)  N2O4(g)ΔH=-52.7kJ·mol-1
N2O4(g)ΔH=-52.7kJ·mol-1
写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式: ;
(2)工业上用次氯酸钠与过量的氨气反应制备肼,该反应的化学方程式为: ;
(3)工业上可以用下列反应原理制备氨气:
2N2(g)+6H2O(l) 4NH3(g)+3O2(g)ΔH=Q kJ·mol-1
4NH3(g)+3O2(g)ΔH=Q kJ·mol-1
①已知该反应的平衡常数K与温度的关系如图,则此反应的 Q 0 (填“>”“<”或“=”)。
②若起始加入氮气和水,15分钟后,反应达到平衡,此时NH3的浓度为0.3mol/L,则用氧气表示的反应速率为 。
③常温下,如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时, (选填编号).
| A.容器中气体的平均相对分子质量不随时间而变化 |
| B.v(N2)/v(O2)=2∶3 |
| C.容器中气体的密度不随时间而变化 |
| D.通入稀有气体能提高反应的速率 |
E.若向容器中继续加入N2,N2的转化率将增大
(4)最近华南理工大提出利用电解法制H2O2并以此处理废氨水,装置如图。
①为不影响H2O2的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中
c(NH4+) c(NO3-)(填“>”“<”或“=”);
②Ir—Ru惰性电极有吸附O2作用,该电极的电极反应为 ;
③理论上电路中每转移3mol电子,最多可以处理NH3·H2O的物质的量为 。
钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域。
(1)CoxNi(1-x)Fe2O4(其中Co、Ni均为+2)可用作H2O2分解的催化剂,具有较高的活性。
①该催化剂中铁元素的化合价为 。
②图1表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知: 法制取得到的催化剂活性更高;Co2+、Ni2+两种离子中催化效果更好的是 。
(2)草酸钴是制备钴的氧化物的重要原料。下图2为二水合草酸钴(CoC2O4·2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物。
①通过计算确定C点剩余固体的化学成分为 (填化学式)。试写出B点对应的物质与O2在225℃~300℃发生反应的化学方程式: 。
②取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL 5 mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比。
氯化亚铜(CuCl)是一种白色固体,微溶于水,不溶于酒精。研究该物质的应用新领域、生产新方法及生产过程中的环保新措施都具有重要意义。
(1)镁—氯化亚铜海水电池,可用于鱼雷上。该电池被海水激活时,正极导电能力增强,同时产生气泡,则正极上被还原的物质有 、 (填化学式)。
(2)工业上以铜作催化剂,氯代甲烷和硅粉反应合成甲基氯硅烷的过程中产生大量废渣(主要成分为硅粉、铜、碳等)。某课外小组以该废渣为原料制CuCl,流程示意图如下:
回答下列问题:
①氯代甲烷有4种,其中属于重要工业溶剂的是 (写出化学式)。
②“还原”阶段,SO32-将Cu2+还原得[CuCl2]-,完成下列离子方程式。 Cu2++
Cu2++ Cl-+
Cl-+ SO32-+
SO32-+ =
= [CuCl2]-+
[CuCl2]-+ +
+
③在稀释过程中存在下列两个平衡:
ⅰ.[CuCl2]- CuCl+Cl- K=2.32
CuCl+Cl- K=2.32
ⅱ.CuCl(s) Cu+(aq)+Cl- Ksp=1.2×10-6
Cu+(aq)+Cl- Ksp=1.2×10-6
当[CuCl2]-完成转化时(c([CuCl2]-)≤1.0×10-5 mol·L-1),溶液中c(Cu+)≥ 。
④获得CuCl晶体需经过滤、洗涤、干燥。洗涤时,常用无水乙醇代替蒸馏水做洗涤剂的优点是 (写一点)。
(3)工业生产CuCl过程中产生浓度为2~3 g·L-1的含铜废水,对人及环境都有较大的危害,必须进行回收利用。用萃取法富集废水中的铜,过程如下:
①实验室完成步骤ⅰ时,依次在分液漏斗中加入曝气后的废水和有机萃取剂,经振荡并 后,置于铁架台的铁圈上静置片刻,分层。分离上下层液体时,应先 ,然后打开活塞放出下层液体,上层液体从上口倒出。
②写出步骤ⅱ的离子方程式: 。