硫酸盐在生产生活中有广泛应用。
Ⅰ.工业上以重晶石(主要成分BaSO4)为原料制备BaCl2,其工艺流程示意图如下:
某研究小组查阅资料得:
BaSO4(s)+4C(s) 4CO(g)+BaS(s)△H1=+571.2kJ•mol-1 ①
4CO(g)+BaS(s)△H1=+571.2kJ•mol-1 ①
BaSO4(s)+2C(s) 2CO2(g)+BaS(s)△H2=+226.2kJ•mol-1 ②
2CO2(g)+BaS(s)△H2=+226.2kJ•mol-1 ②
(1)用过量NaOH溶液吸收气体,得到硫化钠。该反应的离子方程式是 。
(2)反应C(s)+CO2(g) 2CO(g)的△H= 。
2CO(g)的△H= 。
(3)实际生产中必须加入过量的炭,同时还要通入空气,其目的有两个
①从原料角度看, ;
②从能量角度看,①②为吸热反应,炭和氧气反应放热维持反应所需高温。
(4)该小组同学想对BaSO4在水中的沉淀溶解平衡做进一步研究,查资料发现在某温度时BaSO4在水中的沉淀溶解平衡曲线如图所示。
该小组同学提出以下四种观点:
①当向含有SO42-的溶液中加入Ba2+ 使SO42-沉淀完全,则此时SO42-在溶液中的浓度为0
②加入Na2SO4可以使溶液由a点变到b点
③通过蒸发可以使溶液由d点变到c点
④d点无BaSO4沉淀生成
其中正确的是 (填序号)。
Ⅱ.某燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为2H2+O2═2H2O。
请回答:
(5)H+由 极通过固体酸电解质传递到另一极(填a或者b)。
(6)b极上发生的电极反应是 。
(8分)BGO是我国研制的一种闪烁晶体材料,曾用于诺贝尔获得者丁肇中的著名实验,它是锗酸铋的简称。若知:①在BGO中,锗处于最高价态;②在BGO中,铋的价态与铋跟氯形成某种共价氯化物时所呈的价态相同,在此氯化物中铋具有最外层8电子稳定结构;③BGO可看成是由锗和铋两种元素的氧化物所形成的复杂的氧化物,且在BGO晶体的化学式中,这两种氧化物所含氧的总质量相同,请填空:
(1)锗和铋的元素符号是_______________和_______________。
(2)BGO晶体的化学式是_____________________________________________。
(3)BGO晶体中所含铋的氧化物的化学式是______________________________。
(8分)参考下表中物质的熔点,回答有关有问题。
| 物质 |
NaF |
NaCl |
NaBr |
NaI |
NaCl |
KCl |
RbCl |
CsCl |
| 熔点/℃ |
995 |
801 |
755 |
651 |
801 |
776 |
715 |
646 |
| 物质 |
SiF4 |
SiCl4 |
SiBr4 |
SiI4 |
SiCl4 |
GeCl4 |
SnCl4 |
PbCl4 |
| 熔点/℃ |
-90.4 |
-70.4 |
5.2 |
120 |
-70.4 |
-49.5 |
-36.2 |
-15 |
(1)钠的卤化物及碱金属的氯化物的熔点与卤离子及碱金属离子的________________有关,随着________________的增大,熔点依次降低。
(2)硅的卤化物熔点及硅、锗、锡、铅的氯化物的熔点与________________________有关,随着________________增大,________________增大,故熔沸点依次升高。
(3)钠的卤化物的熔点比相应的硅的卤化物的熔点高得多,这与________________有关,因为一般________________比________________熔点高。
(14分)今有三种物质AC2、B2C2、AD4,元素A的最高正价和负化合价绝对值相等,元素B的单质能在C的气态单质中剧烈燃烧,火焰呈黄色,并生成淡黄色固体B2C2;
元素D的负一阶阴离子电子层结构与氩原子相同,则:
(1)A、B、C、D的元素符号为A_______________、B_______________、C_______________、D_______________。
(2)AC2、B2C2、AD4的电子式分别为_______________、______________、______________。
(3)AC2的分子空间构型是_______________,属于_______________ (填“极性”或“非极性”)分子。AD4分子的空间构型是______________,属于_____________(填“极性”或“非极性”)分子。
(4)B2C2中既含有_______________键,又含有_______________键,属于_______________ (填“离子”或“共价”)化合物。
(8分)含羟基的化合物可表示为M—OH(M不确定);当它与H+结合可后形成M—OH+
2离子(有机反应中的重要中间体);在一定条件下,易失去H+或H2O分子。请回答:
(1)符合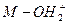 通式最简单的离子的电子式为____________________________________。
通式最简单的离子的电子式为____________________________________。
(2)粒子中原子数、电子数都相等的粒子称为等电子体。等电子体有相似的几何形状,上面(1)题中离子的几何形状为_____________________________。
(3)同温同压下,由A.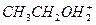 ;B.
;B.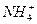 ;C.
;C. 三者分别形成的水溶液酸性由强到弱的顺序为____________________(填序号)。
三者分别形成的水溶液酸性由强到弱的顺序为____________________(填序号)。
(4)液态乙醇中存在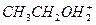 ,可与之相互中和而使液体呈中性的粒子为__________。
,可与之相互中和而使液体呈中性的粒子为__________。
a、b、c、d、e、f、g为七种由短周期元素构成的粒子,它们都有10个电子,其结构特
点如下:
粒子代码:a b c d e f g
原子核数:单核单核双核多核单核多核多核
电荷数: 0 1+ 1- 0 2+ 1+ 0
(单位电荷)
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子极性分子;c与f可形成两
个共价型g分子。
试写出:(1)a粒子的原子结构示意图________________________________________.
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为__________>__________(用化学式表示)。
(3)d溶于水的电离方程式__________________。
(4)g粒子所构成的晶体类型属__________________。
(5)c粒子是__________________,f粒子是__________________ (用化学式表示)。