某有机物A在一定条件下的转化关系如图所示,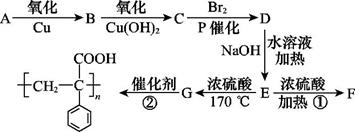
其中两分子E生成环状化合物F,D的结构简式为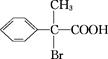
回答下列问题:
(1)写出反应类型:① ,② (每空2分)。
(2)写出有机物C、F的结构简式: 、 (每空2分)。
(3)写出下列化学方程式:A—B: ,E—G: (每空2分)。
(4)C的同分异构体有多种,其中属于苯的二取代物,且既能有银镜反应,遇FeCl3溶液又能呈紫色的同分异构体有 种,请写出其中任意一种的结构简式: 。
离子液体是一种室温熔融盐,为非水体系,由有机阳离子、
和
组成的离子液体作电解液时,可在钢制品上电镀铝。
(1)钢制品应接电源的极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为。若改用
水溶液作电解液,则阴极产物为。
(2)为测定镀层厚度,用
溶液溶解钢制品表面的铝镀层,当反应转移6
电子时,所得还原产物的物质的量为
。
(3)用铝粉和
做铝热反应实验,需要的试剂还有。
.
.
.
.
取少量铝热反应所得到的固体混合物,将其溶于足量稀 ,滴加 溶液无明显现象,(填"能"或"不能")说明固体混合物中无 ,理由是(用离子方程式说明)。
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
(
)+
(
) (
)+
(
)
∆
(I)
(
)+
(
)
∆
(I)
(
)+
(
)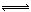 (
)
∆
(II)
(
)
∆
(II)
(1)
(
)+
(
)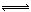 (
)+
(
)+
(
)的平衡常数
=(用
、
表示)。
(
)+
(
)+
(
)的平衡常数
=(用
、
表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向
恒容密闭容器中加入
和
,
时反应(II)达到平衡。测得
内
(
)=
×
-
•L-
•
-
,则平衡后n(
)=
,
的转化率
=。其它条件保持不变,反应(II)在恒压条件下进行,平衡时
的转化率
(填"
""
"或"
"),平衡常数
(填"增大""减小"或"不变"。若要使
减小,可采用的措施是。
(3)实验室可用
溶液吸收
,反应为
+2NaOH=
+
+
。含
NaOH的水溶液与
恰好完全反应得
溶液A,溶液B为
•
‾1的
溶液,则两溶液中c(
‾)、c(
-)和c(
‾)由大到小的顺序为。(已知
的电离常数
=
×
-
•L‾
,
的电离常数
=
×
-
•
‾
,可使溶液A和溶液B的
相等的方法是()。
| A. |
a.向溶液A中加适量水 b.向溶液A中加适量 c.向溶液B中加适量水 d.向溶液B中加适量 |
化合物
和单质
在一定条件下反应可生成化合物
。回答下列问题:
(1)已知
的熔点和沸点分别为-93.6 ℃和76 ℃,
的熔点为167 ℃。室温时
与气体
反应生成lmol
,放出热量123.8 kJ。该反应的热化学方程式为。
(2)反应
 在容积为10 L的密闭容器中进行。起始时
和
均为0.2
。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
在容积为10 L的密闭容器中进行。起始时
和
均为0.2
。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
①列式计算实验a从反应开始至达到平衡时的反应速率
=。
②图中3组实验从反应开始至达到平衡时的反应速率
由大到小的次序为(填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b、c。
③用
表示开始时总压强,
表示平衡时总压强,
表示
的平衡转化率,则
的表达式为;实验
和
的平衡转化率:
为、
为。
、
、
、
、
为短周期元素,非金属元素
最外层电子数与其周期数相同,
的最外层电子数是其所在周期数的2倍。
在
中充分燃烧能生成其最高价化合物
。
与
具有相同的电子数。
在
中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)
在周期表中的位置是,写出一种工业制备单质F的离子方程式。
(2)
、
、
组成的一种盐中,
的质量分数为43%,其俗名为,其水溶液与
单质反应的化学方程式为;在产物中加入少量
,反应后加人
并振荡,有 机层显色。
(3)由这些元素组成的物质,其组成和结构信息如下表:
| 物质 |
组成和结构信息 |
| 含有
的二元离子化合物 |
|
| 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
|
| 化学组成为 | |
| 只存在一种类型作用力且可导电的单质晶体 |
的化学式为;
的化学式为;
的电子式为;
的晶体类型是。
(4)由
和
、
元素组成的两种二元化合物形成一类新能源物质。一种化合物分子通过键构成具有空腔的固体;另一种化合物(沼气的主要成分)分子进入该空腔,其分子的空间结构为。
[物质结构与性质]
含有
的
悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米
。
(1)
+基态核外电子排布式为
(2)与
-互为等电子体的一种分子为(填化学式)。
(3)醛基中碳原子的轨道杂化类型是;
乙醛分子中含有
的键的数目为。
(4)含有
的
悬浊液与乙醛反应的化学方程式为。
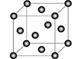
(5)
在稀硫酸中生成
和
。铜晶胞结构如图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为。