碳酸氢钠(
)俗称"小苏打",在生活中用途广泛.某化学实验小组的同学对碳酸氢钠的性质进行探究.
【探究实验1】碳酸氢钠溶液的酸碱性
用试管取适量碳酸氢钠溶液,滴加酚酞试液,振荡,溶液变浅红色.结论:
【探究实验2】能与酸反应
取适量碳酸氢钠加入试管中,滴加稀盐酸,再把燃着的木条迅速伸入试管,木条熄灭,碳酸氢钠和盐酸的化学反应方程式:
【探究实验3】能与碱反应
查阅资料:
;氢氧化钙微溶于水.用试管取适量碳酸氢钠溶液,滴加氢氧化钠溶液,无明显现象.(提示:可以选择
溶液做试剂,通过证明有
生成,从而证明二者发生了反应)如图,两位同学分别进行了甲、乙两个实验.回答下列问题:
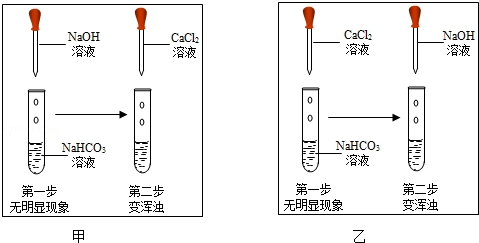
比较甲、乙两个实验的目的性区别是
有同学提出两个实验都不足以证明有
生成,其理由
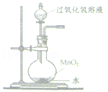
用氢气还原氧化铜的方法测定某氧化铜样品的纯度(杂质不与氢气反应),同学们设计了以下实验装置,准确称取15克干燥样品进行实验.
(1)在实验中,乙装置的作用是.
(2)准确称取完全反应前后装置丙和丁的质量如表:
| 装置丙 |
装置丁 |
|
| 反应前 |
48.8克 |
161.2克 |
| 反应后 |
46.5克 |
163.9克 |
小丽想根据装置丁的质量变化进行计算,请帮小丽求出氧化铜样品的纯度(写出计算过程).
(3)比较两种计算结果,请解析导致这一结果的原因可能是.
| A. |
装置的气密性不好 |
B. |
空气中的水分被丁处浓硫酸吸收 |
C. |
通入的氢气量不足 |
D. |
空气中的二氧化碳被丁处浓硫酸吸收. |
如图装置可验证二氧化碳和氢氧化钠发生了化学反应:将等量的氢氧化钠溶液和蒸馏水分别加入两瓶等量二氧化碳气体中,用
型管连接.充分反应后放在水平桌面上可观察到
型管中液面出现高度差.
(1)室温下利用此装置,你还可以研究.
A.比较氧气和二氧化碳在水中的溶解能力
B.比较氯酸钾和氯化钠在水中的溶解能力
C.比较饱和氢氧化钠和氢氧化钙溶液吸收二氧化碳气体的能力
(2)进一步思考、迁移:有变化的对比实验都可以用此装置进行探究.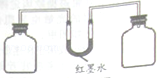
用过氧化氢制氧气时,有同学对事先在烧瓶中加水产生了疑问.他提出了猜想:
猜想1:加水可以起到稀释的作用,使反应速度变缓.
猜想2:…
并根据猜想进行了实验:每次取15毫升15%的过氧化氢溶液,稀释成不同溶质质量分数,在其他条件相同的情况下进行实验.记录数据如下:
| 实验 |
1 |
2 |
3 |
4 |
5 |
| 过氧化氢溶液溶质质量分数 |
1% |
3% |
5% |
10% |
15% |
| MnO2粉末用量/克 |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
| 收集到500mL气体时所用时间/秒 |
560 |
186 |
103 |
35 |
12 |
| 反应后液体温度/℃ |
26 |
38 |
43 |
59 |
71 |
(1)实验室用过氧化氢制氧气的化学方程式是.
(2)过氧化氢溶液的溶质质量分数对反应速度有怎样的影响?.
(3)根据表中数据可知,该同学的猜想2是:加水可以.
同学们发现
溶液与
溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应? 在老师的帮助下,他们通过以下探究过程证明
溶液与
溶液发生了反应。
(1)实验装备
①查阅资料:
②用一定溶质的质量分数的
、
和
三种溶液进行如下实验,为设计实验方案提供参考。
| NaHCO3溶液 |
NaOH溶液 |
Na2CO3溶液 |
|
| 加入稀盐酸 |
现象Ⅰ |
无明显变化 |
产生气泡 |
| 加入澄清石灰水 |
溶液变浑浊 |
无明显变化 |
现象Ⅱ |
| 加入CaCl2溶液 |
无明显变化 |
溶液变浑浊 |
溶液变浑浊 |
| 加热溶液至沸腾,将 气体通入澄清石灰水 |
澄清石灰水 变浑浊 |
澄清石灰水 无明显变化 |
澄清石灰水 无明显变化 |
表中的现象Ⅰ为,现象Ⅱ对应反应的化学方程式为。
(2)实验过程
【实验1】证明反应生成了
同学们选用上表实验中的药品,设计了如图所示实验,先在
溶液中加入A溶液,无明显现象,再滴加
溶液,溶液变浑浊,则A溶液是。 有同学提出这个实验不足以证明有
生成,其理由是。为了证明有
生成,需要继续进行的操作是。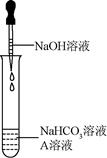
【实验2】证明反应后
不存在
同学们参考上表中的实验,又设计了一个实验,虽然没有观察到明显的实验现象,但可以证明反应发生了,该实验方案是。
(3)实验反思
通过实验1和实验2说明,对于没有明显现象的化学反应,可以从两个不同的角度证明反应的发生,这两个角度是。
2012年1月,广西河池宜州市境内龙江河发生了镉浓度超标事件。根据该事件某化学活动小组开展了一次关于金属镉与铜、银活动性顺序的探究及镉污染事故处理方法的研讨活动。
查阅资料:①镉(Cd)是一种银白色金属,在化合物中通常表现为+2价②水体中镉元素通常以氯化镉的形式存在③氯化镉能溶于水,氢氧化镉难溶于水
(一)金属镉与铜、银活动性顺序的探究
| 实验步骤 |
实验现象 |
实验结论 |
| 取适量镉、铜、银于试管中,加入足量 | 镉表面有气泡产生,铜、银表面无气泡产生 |
镉的活动性顺序大于铜与银 |
| 取适量铜于试管中,加入少量硝酸银溶液 |
, 。 |
铜的活动性顺序大于银 |
实验结论:活动性顺序:镉〉铜〉银
(二)对镉污染事故处理方法的讨论
小聪认为可用向受污染河段抛撒过量烧碱固体的方法除去氯化镉,反应原理用化学方程式表示为。小敏认为该方案虽然有效,但有缺陷,原因是。受小聪与小敏启发,你认为可以用(写俗称)代替烧碱。