铜和镁的合金2.3 g完全溶于浓HNO3,若反应中硝酸被还原只产生2.240 L的NO2气体和168 mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生产沉淀的质量为
| A.4.1275g | B.4.255 g | C.8.51 g | D.9.62 g |
下列说法不正确的是
| A.向AlCl3溶液中滴加氨水,产生白色沉淀,再加入盐酸,沉淀消失 |
| B.向铜粉中加入稀硫酸,铜粉不溶解;再加入Cu(NO3)2固体,铜粉溶解 |
| C.向BaCl2溶液中加入Na2SO3溶液,产生沉淀,再加入硝酸沉淀全部溶解 |
| D.向FeCl2溶液中滴加NaOH溶液,产生白色沉淀,沉淀逐渐变为灰绿色,红褐色。 |
下列物质形成的晶体中,其中任何一个原子都被相邻四个原子包围,以共价健形成正四面体,并向空间伸展成网状结构的是
| A.四氯化碳 | B.白磷 | C.金刚石 | D.水晶 |
下列化学用语或模型表示正确的是
A.Cl-离子的结构示意图: |
B.乙醇分子比例模型: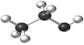 |
| C.次氯酸的结构式:H—O—Cl | D.氢氧化钠的电子式: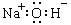 |
化学与科学、技术、社会、环境密切相关。下列有关说法中不正确的是
| A.光缆在信息产业中有广泛应用,制造光缆的主要材料是二氧化硅 |
| B.海轮外壳上镶入铅块,可减缓船体的腐蚀速率 |
| C.大力开发和应用氢能源有利于实现“低碳经济” |
| D.高温能杀死H1Nl流感病毒的原因是蛋白质受热变性 |
一种新燃料电池,一极通入空气,另一极通入丁烷(C4H10)气体,电池的总反应是:
2C4H10 + 13O2 → 8CO2 + 10H2O,电解质溶液是稀H2SO4溶液。下列对该燃料说法正确的是()
| A.在电解质溶液中,SO42-由负极移向正极 |
| B.丁烷在反应过程中被还原 |
| C.通入空气的一极是正极,电极反应为:O2 + 4e- + 4H+ = 2H2O |
| D.通入丁烷的一极是负极,电极反应为:C4H10 + 26e- + 8H2O = 4CO2 + 26 H+ |