1200℃时可用反应 2BBr3(g)+ 3H2(g)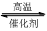 2B(s) + 6HBr(g) 来制取晶体硼。完成下列填空:
2B(s) + 6HBr(g) 来制取晶体硼。完成下列填空:
(1)下列说法能说明该反应达到平衡的是______(选填序号,下同)。
a. v正(BBr3)= 3v逆(HBr) b. 2c(H2) = c(HBr)
c.密闭容器内压强不再变化 d. 容器内气体平均摩尔质量不再变化
(2)若密闭容器体积不变,升高温度,晶体硼的质量增加,下列说法正确的是_________。
a. 在平衡移动时正反应速率先增大后减小
b. 在平衡移动时逆反应速率始终增大
c. 正反应为放热反应
d. 达到新平衡后反应物不再转化为生成物
(3)若上述反应在10L的密闭容器内反应,5min后,气体总质量减少1.1 g,则该时间段内氢气的平均反应速率为__________________。
(4)往容器中充入0.2 mol BBr3和一定量H2,充分反应达到平衡后,混合气体中HBr百分含量与起始通入H2的物质的量有如图关系。在a、b、c三点中,H2 的转化率最高的是______(选填字母)。b点达到平衡后,再充入H2使平衡到达c点,此过程中平衡移动的方向为__________(填“正向”、“逆向”或“不移动”)。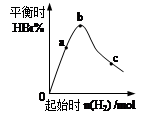
瑞士化学家米勒因合成DDT于1948年获得诺贝尔奖。在第二次世界大战中的1944年,美国在意大利的许多士兵因使用DDT来扑灭传染斑疹伤寒流行病人身上的虱子而避免丧生。联合国世界卫生组织曾评价说:“单独从疟疾病者,DDT可能拯救了5 000万生命。”但进一步的观察和研究表明,DDT是一种难降解的有毒化合物,进入人体内可引起慢性中毒。我国已于1983年停止生产和使用。
(1)杀虫剂“1605”本身对人畜毒性远强于DDT,但DDT已被禁用,而“1605”尚未禁用,这是为什么?________________________________________________________________。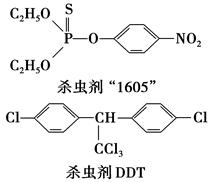
由结构分析知:“1605”在使用过程中,不能与________物质混合使用,否则会因________。
(2)DDT可以用电石为原料经以下途径而制得:
①写出④⑤⑥步反应的化学方程式。
②DDT有毒性,国际上已禁止使用,因为它在动物体内转化为一种使动物生长失调的物质(结构简式如下)。在实验室也可实现这种转化,表示这种转化的化学方程式为____________________________________________________________。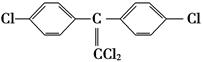
蚂蚁等群居性昆虫在找到食物后的归巢途中,用一种自身分泌物涂在地上,为其他蚂蚁觅食引路。这种分泌物叫跟踪剂,是信息素的一种。所谓信息素,是指同种生物个体间用来传递信息的化学物质。蚂蚁跟踪信息素叫牻牛儿醇(又叫香叶醇),可用作香料或昆虫引诱剂。对其组成分析结果为:含C:77.86%,H:11.76%,O:10.37%,相对分子质量为154。此信息素与臭氧反应,生成臭氧化物;再与水和Zn反应,发生水解,使分子中双键断裂,其规律

(1)通过计算写出此信息素的化学式为__________________________________________;
(2)此信息素的结构简式为_________________________________________________;
(3)此信息素的系统命名为________________________________________________。
将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。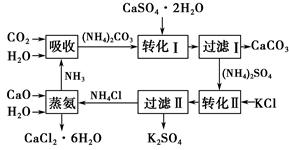
(1)本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要________等原料。
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式:______________________________________________________________。
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有________(填化学式)等物质,该固体可用作生产水泥的原料。
(4)过滤Ⅰ操作所得滤液是(NH4)2SO4溶液。检验滤液中含有CO32-的方法是:_______________________________________________________________。
(5)已知不同温度下K2SO4在100 g水中达到饱和时溶解的量如下表:
| 温度/℃ |
0 |
20 |
60 |
| K2SO4溶解的量/g |
7.4 |
11.1 |
18.2 |
60 ℃时K2SO4的饱和溶液591 g冷却到0 ℃,可析出K2SO4晶体________g。
(6)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是________。
a.熔点较低(29 ℃熔化) b.能导电
c.能制冷 d.无毒
(7)上述工艺流程中体现绿色化学理念的是:________________________________________________________________。
当前,大量施用氮素化肥是冬小麦获得高产的重要措施之一。
(1)施入土壤的氮素化肥主要以________形式被小麦根部吸收,透气性较好的土壤植物容易吸收氮素化肥,透气性较差的黏质土壤,则根的吸肥力差,这是因为_______________________________________________。
(2)施肥后要及时灌溉,若从麦田流失的水从下图A位置注入一条河流,导致下游水体中藻类和细菌数量发生的变化如下列曲线图所示: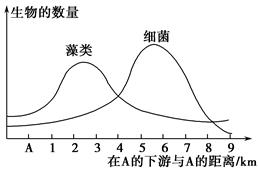
①在A的下游藻类数量增加的原因是____________________________________________________________。
②在3 km以外的河段,细菌数量迅速增加的原因是_____________________________________________________________。
③在下游6 km处的河段发现鱼类大量死亡,原因是______________________________________________________________。
④在距A 2 km处,水中的氧气含量比A处高,原因是______________________________________________________________。
获取知识和信息是现代人不可缺少的素质,信息产业的飞速发展离不开材料科学的推动。信息产业的核心材料是高纯度的硅,单晶硅可用来制作大规模集成电路、整流器等,硅纯度越高,大规模集成电路的性能就越好。高纯度的单晶硅生产方法有:
方法一:三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下: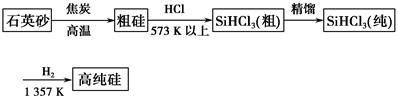
方法二:用金属硅化物(Mg2Si)与盐酸作用制得硅烷,再热分解硅烷可得高纯硅。
根据上述信息回答以下问题:
(1)从方法一生产单晶硅的过程看,由焦炭还原得到的硅为何还要进一步处理?_________________________________________________________。
(2)写出方法二中生产高纯硅的两个化学方程式:
①____________________________________________________________;
②__________________________________________________________。
(3)写出由纯SiHCl3制备高纯硅的化学方程式:____________________________________。
(4)在方法一中,整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式:________________;H2还原SiHCl3过程中若混入O2,可能引起的后果是_____________________________________________________。
(5)比较方法一和方法二,分析一下各自的优缺点____________________________________。