钯催化偶联反应可表示为:R-X + CH2=CH-R’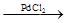 R-CH="CH-R’" + HX。美国化学家Richard F. Heck因研究此反应获2010年诺贝尔化学奖。以下是利用钯催化偶联反应合成一种香料A(
R-CH="CH-R’" + HX。美国化学家Richard F. Heck因研究此反应获2010年诺贝尔化学奖。以下是利用钯催化偶联反应合成一种香料A( )的流程:
)的流程:
完成下列填空:
(1)写出结构简式。B________________ E________________
(2)写出反应②的化学方程式______________________________________________。
(3)反应④属于____________(填反应类型)。反应⑤的条件是____________。
(4)为了促进反应⑥的进行,通常可以加入一种显_________的物质。
a. 强酸性 b. 弱酸性 c. 弱碱性 d. 强碱性
(5)写出A的两种符合下列条件的同分异构体的结构简式____________、___________。
i. 含有两个苯环(除苯环外不含其它环状结构);
ii. 只存在四种化学环境不同的氢原子。
(6)仅以B为有机原料,任选无机试剂,经过三步反应可得到一种含有六元环的酯。写出相关反应的化学方程式。
甲醇是一种可再生燃料。在容积为2L的密闭容器中进行反应:CO(g)+2H2(g) CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示。
CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示。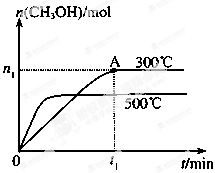
(1)该反应的△H0 (填>、<或=)
(2)300℃时,0-t1min内 CH3OH的平均生成速率为
(3)若要提高甲醇的产率,可采取的措施有_______。(填字母)
A 缩小容器体积 B 降低温度
C 升高温度D 使用合适的催化剂
E.甲醇从混合体系中分离出来
(4)300℃时,CO、H2的起始物质的量分别为2mol和3mol,若图中n1数据为0.5mol,试计算300℃下,该反应的平衡常数(写出计算过程,保留两位有效数字)
(5)工业上也可以用CO2和H2反应制得甲醇。在2×105Pa、300℃的条件下,若有440g CO2与H2恰好完全反应生成甲醇和水,放出495kJ的热量,试写出该反应的热化学方程式。
丙烯酸乙酯(化合物Ⅳ)是制备塑料、树脂等高聚物的重要中间体,可由下面路线合成: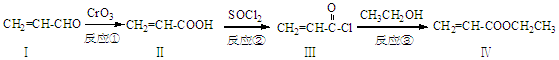
(1)化合物Ⅳ的分子式为,1 mol化合物Ⅳ完全燃烧消耗O2为mol。
(2)化合物Ⅱ能使溴水褪色,其反应方程式为。
(3)反应②属于反应,化合物Ⅰ可以由化合物Ⅴ(分子式为C3H6O)催化氧化得到,则化合物Ⅴ→Ⅰ的反应方程式为。
(4)化合物Ⅵ是化合物Ⅳ的同分异构体,Ⅵ含碳碳有双键并能与NaHCO3溶液反应放出气体,其核磁共振氢谱峰面积之比为1:1:6,则化合物Ⅵ的结构简式为。
(5)一定条件下,化合物 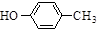 也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为。
也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为。
水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s) + H2O(g) CO (g) +H2 (g)△H= +131.3 kJ•mol-1
CO (g) +H2 (g)△H= +131.3 kJ•mol-1
(1)该反应的平衡常数K随温度的升高而___________(增大 / 减小 / 不变)。
(2)上述反应达到平衡后,将体系中的C (s)全部移走,平衡_______________(向左移 / 向右移 / 不移动)。
(3)下列事实能说明该反应在一定条件下已达到平衡状态的有_______(填序号)。
| A.单位体积内每消耗1 mol CO的同时生成1molH2 |
| B.混合气体总物质的量保持不变 |
| C.生成H2O(g)的速率与消耗CO的速率相等 |
| D.H2O(g)、CO、H2的浓度相等 |
(4)上述反应在t0时刻达到平衡(如下图),若在t1时刻改变某一条件,请在右图中继续画出t1时刻之后c(CO)随时间的变化。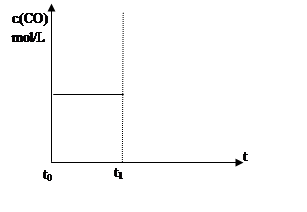
① 缩小容器体积(用实线表示)。
② 降低温度(用虚线表示)。
(5)某温度下,将6.0 mol H2O(g)和足量的炭充入2 L的密闭容器中,发生如下反应,
C (s) + H2O(g) CO (g) +H2 (g),达到平衡时测得lgK= -1.0,求此温度下H2O(g)的
CO (g) +H2 (g),达到平衡时测得lgK= -1.0,求此温度下H2O(g)的
转化率(计算结果保留3位有效数字,要求写出计算过程)。
(6)己知:① C (s) + H2O(l) CO (g) +H2 (g)△H1
CO (g) +H2 (g)△H1
② 2CO(g) + O2(g) = 2CO2 (g)△H2
③ H2O (l)= H2 (g) +1/2 O2 (g)△H3
则2C (s) + O2 (g) = 2CO2 (g)的△H= _____________。
A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号:A _________ B__________ C __________ D __________
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是__________,碱性最强的是_________。
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是__________,电负性最大的元素是__________。
(4)D的氢化物比C的氢化物的沸点__________(填"高"或"低"),原因_____________ (5)E元素原子的核电荷数是__________,E元素在周期表的第_______周期,第________族,已知元素周期表可按电子排布分为s区、p区等,则E元素在_______区。
(5)E元素原子的核电荷数是__________,E元素在周期表的第_______周期,第________族,已知元素周期表可按电子排布分为s区、p区等,则E元素在_______区。
(6)A、B、C最高价氧化物的晶体类型是分别是______晶体、______晶体、______晶体
(7)画出D的核外电子排布图___________________________________________,这样排布遵循了____________原理和____________规则。 (8)用电子式表示B的硫化物的形成过程:_____________________________________
(8)用电子式表示B的硫化物的形成过程:_____________________________________
(12分)水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为__________;
(2)写出与H2O分子互为等电子体的微粒__________(填2种)。
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是_____
| A.氧原子的杂化类型发生了改变 | B.微粒的形状发生了改变 |
| C.微粒的化学性质发生了改变 | D.微粒中的键角发生了改变 |
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是_____(请用相应的编号填写)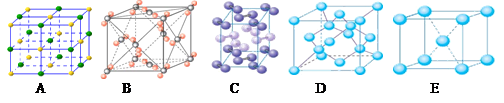
(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能” 是_________kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式:。